Elyse Foster and Katy Lease
Người dịch:BS Lê Thị Đẹp
Một người đàn ông 67 tuổi có tiền sử hẹp van động mạch phổi bẩm sinh và đã được mổ xẻ van động mạch phổi (valvotomy) từ năm 14 tuổi. Ông được giới thiệu đến để kiểm tra tiếng thổi ở tim, đồng thời có tiền căn cao huyết áp, tăng lipid máu và đái tháo đường đường type II. Ở lần kiểm tra đầu tiên, ông cảm thấy khỏe mạnh, không có biểu hiện của bệnh tim, tuy nhiên ông không thường xuyên luyện tập thể dục.Ông có thể leo 2 lượt cầu thang, nhưng ông cảm thấy mệt khi đi khỏang cách xa hơn. Khám lâm sàng phát hiện mất tiếng P2 và âm thổi giữa tâm thu (mid – peaking) vùng cạnh trái xương ức, không có tiểng thổi tâm trương, các phần khác đều bình thường. Điện tim phát hiện phì đại thất phải với block phân nhánh phải không hoàn toàn. Siêu âm tim thấy hình ảnh phì đại thất phải (hình 3.1) với chức năng tâm thu thất phải bảo tồn. Van động mạch phổi dày và có độ chênh áp tối đa (peak gradient) qua van là 61 mmHg ở mặt cắt cạnh ức trái. Mặt cắt dưới bờ sườn cho thấy độ chênh áp tối đa là 89 mmHg. Có sự chênh áp động học tối đa muộn( late peaking dynamic gradient) ở buồng tống thất phải lên đến 25 mmHg (hình 3.2). Thân động mạch phổi bị dãn đáng kể.
MỞ ĐẦU:
Hẹp động mạch phổi (PS) là nguyên nhân của hầu hết các trường hợp tắc nghẽn buồng tống thất phải, đây cũng là một bệnh bẩm sinh. Vị trí tắc nghẽn đường thoát thất phải có thể là ở van tim, dưới van hay trên van. Trong ba loại trên, hẹp tại van động mạch phổi thì gặp nhiều nhất và chiếm tỷ lệ đến 10% các bệnh tim bẩm sinh(1). Tổn thương này có thể đi kèm với những bất thường bẩm sinh khác, nhưng bài này chỉ đề cập đến thương tổn hẹp động mạch phổi đơn độc mà thôi. Trong nhiều bệnh tim bẩm sinh, hẹp động mạch phổi là một bệnh có diễn tiến lâm sàng tương đối nhẹ nhàng và có tiên lượng tốt. Vì lý do này, đây là bệnh tim bẩm sinh có biểu hiện lâm sàng khá muộn và có thể được chẩn đoán lần đầu ở tuổi trưởng thành. Rất nhiều bệnh nhân sẽ không cần điều trị gì và những bệnh nhân cần được điều trị thì có thể điều trị thành công với phương pháp thông tim can thiệp qua da.
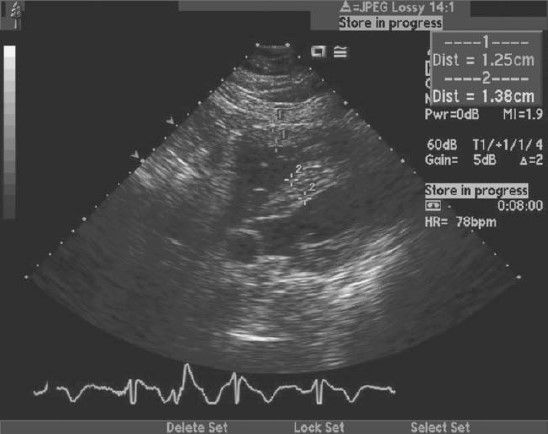
Hình 3.1: Siêu âm tim thấy hình ảnh phì đại thất phải đáng kể ở mặt cắt dưới sườn.(Courtesy of Dr Geoge Cohen)
HẸP TẠI VAN ĐỘNG MẠCH PHỔI:
Bệnh học:
Trong hẹp động mạch phổi do van, van động mạch phổi thường có 3 lá, tuy nhiên do sự dính của các mép van làm cho hẹp lỗ van ở vị trí trung tâm. Lá van vẫn mỏng, trong thời kỳ tâm thu, van mở dạng hình vòm làm hạn chế luồng máu thoát khỏi thất phải. Có thể thấy lá van bị xơ dày với nhiều mức độ khác nhau, nhưng hiếm khi có hình ảnh canxi hóa lá van. Hiếm gặp hơn trong các trường hợp lá van không bị dính ở mép van mà bị dạng nhầy (myxomatous), loạn sản, không di động, những trường hợp này cũng ngăn cản đường thoát của thất phải(1,2). Van động mạch phổi 2 lá thì cực kỳ hiếm gặp trong hẹp động mạch phổi bẩm sinh. Cuối cùng hẹp van động mạch phổi có thể mắc phải trong vài trường hợp như trong hội chứng carcinoid (carcinoid syndrome), ở đây thường có thêm tổn thương van 3 lá.
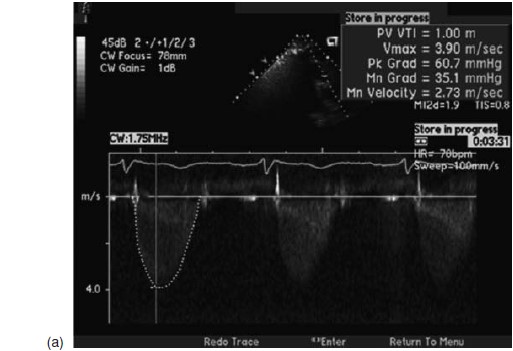
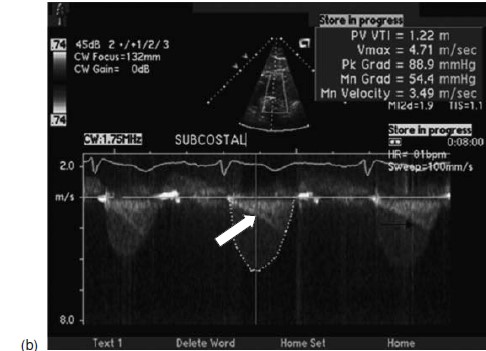
Hình 3.2: (a)Doppler liên tục ở mặt cắt cạnh ức trục ngang: Độ chênh áp tối đa qua van động mạch phổi là 61mmHg. (b) Ở mặt cắt dưới sườn thì độ chênh áp cao hơn: 89 mmHg. Ghi nhận độ chênh áp tối đa muộn 25 mmHg( phần hẹp), hẹp động học buồng tống do phì đại vùng phễu thất phải (Courtesy of Dr Geoge Cohen).
Hẹp van động mạch phổi bẩm sinh có thể liên quan đến một vài bệnh di truyền. Hội chứng Noonan là một bệnh di truyền có liên quan đến tim khoảng 50% các trường hợp, trong đó thường gặp nhất là hẹp van động mạch phổi – kiểu loạn sản lá van. Hội chứng Williams và hội chứng rubella bẩm sinh là những trường hợp hiếm gặp khác liên quan đến hẹp trên van động mạch phổi.
Sinh lý bệnh:
Rối loạn huyết động do hẹp động mạch phổi gây ra tùy thuộc vào mức độ nặng của hẹp . Khi độ chệnh áp qua van (transvalvular gradient) cao hơn áp lực hệ thống thì gây tăng hậu tải trên thất phải, sau đó được bù trừ bằng phì đại thất phải. Hẹp dưới van thứ phát do phì đại phần phễu cũng dẫn đến tắc nghẽn đường thoát thất phải. Áp lực trong động mạch phổi vẫn bình thường hay thấp do sự giảm lượng máu đến phổi vì tắc nghẽn. Tuy nhiên về mặt giải phẫu học, sự dãn thân và các nhánh bên trái của động mạch phổi sau chổ hẹp thường xảy ra ở hẹp van động mạch phổi dạng vòm. Điều này tạo thành do dòng máu xoáy với tốc độ cao đi qua lỗ hẹp, hướng về phía động mạch phổi trái do động mạch phổi trái ngã về trước hơn. Điều lạ là trong hẹp động mạch phổi do loạn sản lá van không thấy sự dãn động mạch phổi sau chổ hẹp.
Đặc điểm lâm sàng:
Bệnh nhân hẹp động mạch phổi thường không biểu hiện triệu chứng, ngay cả khi hẹp nặng. Vì vậy, đây là bệnh tim bẩm sinh thường được phát hiện ở tuổi trưởng thành. Ở tuổi vị thành niên, thường phát hiện khi nghe tiếng thổi đặc trưng ở tim. Tương tự, ở tuổi thành niên, được phát hiện tình cờ tiếng thổi ở tim khi khám bệnh hay thấy tăng độ chênh áp qua van trong lúc siêu âm tim. Khi hẹp động mạch phổi đến giai đoạn nặng, bệnh nhân thường biểu hiện khó thở, đôi khi loạn nhịp tim, đau ngực hay ngất. Đau ngực có thể là do thiếu máu cơ tim ở tâm thất phải do thất phải phì đại. Các biểu hiện lâm sàng khác là do thất phải không thể tăng cung lượng .
Khám thực thể có thể phát hiện ra âm thổi tâm thu dạng phụt hình quả trám nghe rõ nhất ở gian sườn thứ 2. Tương tự như hẹp van động mạch chủ, hình dạng của âm thổi có thể thay đổi theo độ nặng hẹp của van. Khi độ hẹp gia tăng, âm thổi tâm thu có đỉnh muộn và kéo dài, ở mức độ hẹp nặng nhất, âm thổi có thể kéo dài qua cả tiếng đóng van động mạch chủ của tiếng tim thứ 2( S2). Một đặc điểm nữa đó là tiếng click tống máu âm sắc cao ngay sau tiếng tim S1. Trong trường hợp hẹp nhẹ, tiếng click xảy ra chậm sau S1, tuy nhiên trong trường hợp hẹp nặng, tiếng click có thể đi trước hay nhập chung với tiếng S1. Không giống như những tiếng tim bên phải khác, tiếng click tống máu trong hẹp động mạch phổi giảm cường độ khi hít vào. Sự giảm cường độ theo hô hấp cùng với vị trí nghe được tiếng click giúp phân biệt với tiếng click tống máu của van động mạch chủ. Thêm vào đó, khi độ hẹp của động mạch phổi gia tăng, sự tách đôi của tiếng S2 rộng hơn, và trong những trường hợp hẹp nặng, thành phần P2 có thể giảm cường độ và ngay cả không nghe thấy. Xung động tĩnh mạch cảnh thường thấy sóng “a” lớn, biểu hiện gia tăng áp lực nhĩ, khi nhĩ phải co bóp mạnh để tống máu đi vào thất phải mà thất phải thì lại không thể giãn được (noncompliant right ventricle).
Bên cạnh khám lâm sàng, các xét nghiệm cận lâm sàng có thể giúp xác định độ nặng của hẹp động mạch phổi. Điện tim có thể bình thường nhưng thường biểu hiện dày thất phải, trục chuyển phải và lớn nhĩ phải. Độ cao của sóng R ở V1 có liên quan đến độ nặng của hẹp van động mạch phổi(1,2).
Siêu âm tim cho thấy đặc điểm về vị trí, hình thái và độ nặng của hẹp. Mặt cắt cạnh ức trục ngang ở đáy tim cho hình ảnh rõ nhất van động mạch phổi và đường thoát thất phải trên siêu âm 2-D. Nếu hình ảnh của mặt cắt này chưa rõ thì làm mặt cắt dưới sườn theo trục ngang để bổ sung. Siêu âm Doppler có thể tính được độ chênh áp trong hẹp động mạch phổi dựa vào công thức Bernoulli. Doppler liên tục tính được ngay độ chênh áp tối đa. Doppler màu và xung giúp định vị vị trí tắc nghẽn do đó có thể phân biệt được hẹp động mạch phổi tại van, dưới van hay trên van. Hình vòm đặc trưng của van động mạch phổi có thể thấy được trong hầu hết trường hợp hẹp tại van động mạch phổi. Thêm vào là hình ảnh giãn động mạch phổi sau chỗ hẹp cũng thường được thấy (4). Các trường hợp hiếm gặp như dạng nhầy ( myxomatous), hay dính mép van trong các trường hợp loạn sản các lá van cũng được nhìn thấy, trong những trường hợp này không thấy sự giãn thân động mạch phổi. Khó khăn cho những người siêu âm đánh giá độ nặng tắc nghẽn chức năng dưới van, thường kèm theo hẹp tại van động mạch phổi do sự phì đại thứ phát của vùng phễu thất phải, biểu hiện đặc trưng bởi dòng xoáy đỉnh muộn (late peaking jet), tương tự như hẹp động học buồng tống thất trái. Mặt cắt dưới bờ sườn có thể cho phép đo đạc chính xác hơn do sự thẳng hàng của dòng Doppler với dòng máu xoáy vận tốc cao đi ngang qua van động mạch phổi.
Chụp cộng hưởng từ (CMR) là phương cách chẩn đoán hình ảnh bổ sung, có thể hiệu quả trong một số trường hợp hẹp động mạch phổi. CMR cho thấy hình ảnh chi tiết của thất phải và đường thoát của nó, cho phép nhận ra vị trí tắc nghẽn. Phương pháp này rất có ích giúp chẩn đoán phân biệt hẹp van động mạch phổi với tắc nghẽn dưới van do phì đại các dãi cơ thất phải, hay tắc nghẽn trên van do hẹp các nhánh động mạch phổi. Hẹp van động mạch phổi cũng có thể đi kèm với các tổn thương trên. Thêm vào đó CMR là phương pháp lượng giá kích thước và chức năng thất phải, điều mà thực hiện bằng siêu âm 2-D cực kỳ khó khăn(5).
Thông tim là một phương pháp thay thế khác để đánh giá độ nặng của hẹp van động mạch phổi, mặc dù là xâm lấn. Tuy nhiên với sự chính xác của kỹ thuật siêu âm Doppler, thông tim chẩn đoán chỉ dành cho các trường hợp bất thường mà siêu âm không thể đánh giá hết. Thông tim có thể được thực hiện kết hợp với các phương pháp can thiệp để làm giảm hẹp: nong van qua da. Vẽ biểu đồ áp lực trong lúc thông tim để đo áp lực thất phải gần bằng hay hơn áp lực thất trái, cũng như phát hiện sóng “a” lớn của nhĩ phải trong trương hợp hẹp nặng van động mạch phổi. Chụp mạch máu có thể thực hiện trong tư thế nằm nghiêng hoàn toàn hay trước sau, cho thấy hẹp của lỗ van và buồng tống thất phải phì đại(6).
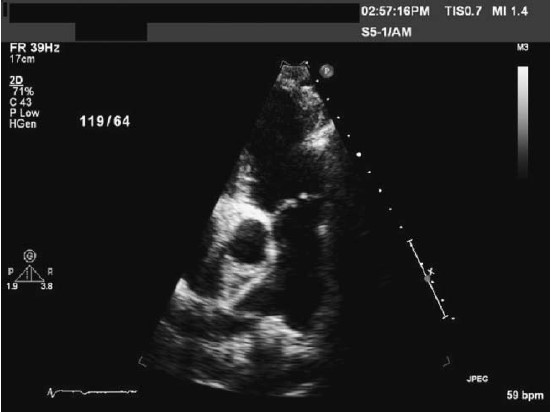
Hình 3.3: Các lá van động mạch phổi dầy nhìn thấy ở mặt cắt cạnh ức trục ngang đường thoát thất phải.
Các phương pháp điều trị:
Trước năm 1980, phẫu thuật sửa van thường được ưu chuộng trong trường hợp hẹp van động mạch phổi. Phương pháp phẫu thuật đơn giản là xẻ mép van hay phức tạp hơn là tái tạo lại đường thoát thất phải có hay không có mảnh ghép. Thay van động mạch phổi có thể được áp dụng cho các trường hợp dị sản van động mạch phổi.
Năm 1982, các kỹ thuật nong van bằng bóng qua da được thực hiện trên bệnh nhân hẹp động mạch phổi trẻ em(7) và người lớn(8). Với kết quả thành công xuất sắc, phương pháp này trở thành lựa chọn điều trị cho cả người lớn và trẻ em. Bóng Inoue ngắn và mềm dẻo thường được áp dụng để hạn chế sang chấn cho buồng tống thất phải, bơm căng bóng trong thời gian ngắn để hạn chế tối thiểu ảnh hưởng trên huyết động học(9-12). Kỹ thuật dùng bóng đôi (13-16) hay bóng ba( triple balloon) (17) cũng được sử dụng khi vòng van lớn hơn ở người trưởng thành. Thông thường đường kính bóng sử dụng lớn hơn đường kính vòng van.
Tiên lượng:
Rất nhiều nghiên cứu cho thấy tiên lượng hẹp van động mạch phổi là rất tốt. Nghiên cứu Second Natural History Study of Congenital Heart Defects là bằng chứng lớn nhất về kết quả lâu dài của bệnh lý này. Nghiên cứu theo dõi kết quả lâm sàng của 592 bệnh nhân hẹp van động mạch phổi từ 1958 đến 1969. Số liệu cho thấy tỷ lệ sống 25 năm của các bệnh nhân này tương đương với nhóm dân số bình thường. Trong nghiên cứu này, những bệnh nhân có độ chênh áp tối đa hơn (peak gradient) 80 mm Hg được phẫu thuật điều trị, và những bệnh nhân ít hơn 25 mm Hg không cần phải điều trị, nhóm giữa 25 và 80 mm Hg có thể nhận được điều trị hay không. Kết quả của nghiên cứu này gợi ý: khi độ chênh áp tối đa dưới 25 mm Hg thì khả năng can thiệp điều trị gần như không có, những người có độ chênh áp từ 25 – 49 mm Hg có 20% cần thiết phải can thiệp điều trị, những bệnh nhân lớn hơn 50 mm Hg thường cần phải được điều trị ở một thời điểm nào đó. Bệnh nhân thường không có triệu chứng gì trong suốt quá trình theo dõi bất kể là bệnh hẹp nặng hay nhẹ, có được điều trị nội khoa hay ngoại khoa hay không(18). Khi khảo sát khả năng dung nạp vận động thể lực theo thang điểm của Bruce, bệnh nhân bệnh hẹp động mạch phổi có thể thực hiện gần như bình thường, với thời gian trung bình là 94% của dự trữ(19). Khảo sát về chất lượng cuộc sống của bệnh nhân gần như bằng với dân số bình thường( 20). Tỷ lệ viêm nội tâm mạc nhiễm trùng ở cả nhóm bệnh nhân điều trị nội khoa hay ngoại khoa thì cực kỳ thấp(21). Khi theo dõi điện tâm đồ liên tục thấy có sự gia tăng tỷ lệ ngoại tâm thu thất và trên thất nhưng không có gia tăng tỷ lệ nhịp nhanh thất(22).
Nghiên cứu trên những trẻ em được phẫu thuật tạo hình van cho thấy kết quả lâu dài rất tốt và tỷ lệ tử vong rất thấp. Theo dõi sau 10 năm, tỷ lệ can thiệp lại rất thấp từ 3 – 4%(6-23). Theo dõi lâu dài hơn từ 20 -30 năm thì có tỷ lệ can thiệp lại từ 15 – 53% chỉ định thường gặp nhất là hở van động mạch phổi( 24-25). Vì vậy, ở những bệnh nhân trưởng thành đã được mổ tạo hình van rồi, bất kỳ những loạn nhịp nào liên quan đến nhĩ hay thất, không thể hoạt động gắng sức, hay có tim to trên x quang thì phải tìm kiếm hở van động mạch phổi. Thay van động mạch phổi phải được thực hiện trước khi xảy ra những suy giảm chức năng tâm thu thất phải.
Trong những năm 1980, tạo hình van qua da( percutaneous valvuloplasty) thực hiện ngày càng dễ dàng để điều trị hẹp van động mạch phổi, và tiên lượng cho thấy tương đương với những bệnh nhân được phẫu thuật. Kết quả tức thì ngay sau thực hiện thủ thuật là giảm độ chênh áp qua động mạch phổi một cách ngoạn mục(9, 26-34),( bảng 3-1). Ở những bệnh nhân có triệu chứng cơ năng, gần như 100% bệnh nhân hết triệu chứng và cải thiện các chức năng (theo đánh phân loại của Hội tim mạch Hoa Kỳ)( 30-31). Tỷ lệ biến chứng của kỹ thuật này rất thấp, hầu hết các nghiên cứu đều không có những biến chứng nghiêm trọng nào xảy ra. Những biến chứng hiếm gặp như: loạn nhịp thất tạm thời hay ngoại tâm thu thất có thể tự hết( 33). Ngay sau khi sửa hay điều chỉnh tắc nghẽn tại van, một biến chứng ngay lập tức thường gặp là sự chênh áp động học còn lại qua vùng phễu thất phải do sự phì đại hay sự tăng co thắt của cơ thất phải, đây là hiện tượng “ thất phải tự sát”( succide right ventricle). Vào những thời điểm này, sự chênh áp có thể đạt đến bằng với mức của hệ thống và hiếm khi gây ra những rối loạn huyết động như tụt huyết áp hay ngất. Trong trường hợp cấp tính, thuốc ức chế beta như propanolol đôi khi có thể ngăn ngừa hoặc làm giảm tình trạng chênh áp cao này. Những nghiên cứu theo dõi sau đó cho thấy có sự giảm dần sự chênh áp còn lại sau nhiều tháng, kết hợp với sự giảm dần phì đại cơ tim vùng phễu thất phải( 9, 26-29, 31, 33). Hiếm khi bệnh nhân cần phải can thiệp lần thứ hai (0 – 9%). Hở van động mạch phổi mức độ nhẹ có thể xảy ra sau khi tái tạo van nhưng nó ảnh hưởng lên huyết động không đáng kể. Tỷ lệ hở động mạch phổi mức độ vừa ngay sau tạo hình van hay theo dõi sau đó chiếm từ 2-7%(30,33), tỷ lệ này ít hơn đáng kể so với phẫu thuật sửa van.
Bảng 3.1: Các nghiên cứu theo dõi nong van bằng bóng ở người trưởng thành qua ít nhất 8 nghiên cứu:
|
Tác giả |
Số bệnh nhân |
Tuổi |
Độ chênh áp lực ( trước và sau) |
Độ chênh áp theo dõi sau đó(mmHg) |
Thời gian theo dõi(trung bình) |
|
Al Kasab và cs(26) |
21 |
15-37 (24) |
93 → 26 |
23 |
12-26 tháng (17 tháng) |
|
Siert và cs (27) |
24 |
17-71 (39) |
92 → 43 |
33 |
3 tháng đến 3 năm |
|
Herrmann và cs(28) |
8 |
23-66 (40) |
62 → 20 |
20 |
24 tháng |
|
Kaul và cs(29) |
40 |
18-56 (27) |
107 → 37 |
31 |
24 tháng |
|
Chen và cs(9) |
53 |
13-55 (27) |
91 → 38 |
19 |
0,2- 9,8 năm (6,9 năm) |
|
Sadr-Ameli |
127 |
16-54 (30) |
108 → 22 |
20 |
6-8 năm |
|
Teupe và cs(31) |
24( n=14 lúc theo dõi) |
19-65 (41) |
82 → 37 |
25 |
4,5-9 năm (6,5 năm) |
|
Lip và cs(32) |
22 |
16-46 (18) |
53 → 15 |
N/A |
20 tháng
|
|
Fawzy và cs(33) |
90(n=85 lúc theo dõi) |
15-54 (23) |
105 → 34 |
26 |
2-17 năm ( 10 năm) |
Mang thai:
Các nghiên cứu phụ nữ mang thai bị bệnh hẹp van động phổi cho thấy tiên lượng cho những bệnh nhân này rất tốt. Ngay cả trong trường hợp sự chênh áp cao gợi ý hẹp nặng, nếu bệnh nhân không triệu chứng hay chỉ có các triệu chứng nhẹ trước khi mang thai thì trong quá trình mang thai các rối loạn huyết động trên bệnh nhân có thể dung nạp được tốt mà ít khi xảy ra các biến chứng trên tim(35,36). Có vài nghiên cứu cho thấy bệnh nhân hẹp động mạch phổi thường bị cao huyết áp nhiều hơn, lý do được giải thích là rối loạn chức năng lớp nội mạc của bệnh tim bẩm sinh(37). Khi mang thai nếu có các biến chứng nặng, hiếm xảy ra, hoặc không đáp ứng với điều trị nội khoa thì kỹ thuật tạo hình van bằng bóng sẽ giúp điều trị thành công(23,38) .
Các hướng dẫn (guidelines)
Hướng dẫn mới nhất theo Hội tim mạch Trường môn Hoa kỳ (American College of Cardiology/ American Heart Association Guidelines ) cho điều trị bệnh nhân trưởng thành bị bệnh Hẹp van động mạch phổi. Hội không khuyến cáo (Class III) thực hiện thông tim thường quy cho bệnh nhân.
- Thông tim chỉ thực hiện (Class I) khi siêu âm tim Doppler phát hiện hẹp đáng kể với chênh áp tối đa lớn hơn 36 mm Hg và nếu có chương trình thực hiện tạo hình van bằng bóng khi có chỉ định.
- Tạo hình van bằng bóng nên thực hiện (Class I) khi chênh áp tối đa qua van động mạch phổi lớn hơn 30 mm Hg qua thông tim (peak to peak gradient by catheterization) và có triệu chứng như: khó thở, đau ngực và ngất. Với những bệnh nhân không triệu chứng, tạo hình van chỉ nên thực hiện khi chênh áp lớn hơn 40 mm Hg.
- Ngoài ra, tạo hình van còn được xem xét (Class IIb) trên bệnh nhân không có triệu chứng nhưng có độ chênh áp từ 30 – 39 mm Hg(39). Mặc dù không có trong guidelines nhưng mọi người công nhận rằng phẫu thuật thay van động mạch phổi chỉ dành cho những trường hợp loạn sản van động mạch phổi, hay có những tật tim khác cần phải được can thiệp phẫu thuật, hoặc các trường hợp phì đại các dải cơ của thất phải cần thiết cắt bớt , căn cứ trên dữ liệu của nghiên cứu The second History Study of Congenital Heart Defects(21) . Guidelines(40) cũng đề nghị những bệnh nhân chỉ bị hẹp động mạch phổi đơn thuần không có mảnh ghép hay những dụng cụ nhân tạo thì không cần phải phòng ngừa viêm nội tâm mạch nhiễm trùng khi chữa răng hay thực hiện các thủ thuật không vô trùng.
HẸP DƯỚI VAN ĐỘNG MẠCH PHỔI
Hẹp dưới van động mạch phổi thường đi kèm với khiếm khuyết vách liên thất( thông liên thất- VSD) và rất hiếm chỉ có hẹp dưới van đơn thuần. Vị trí hẹp có thể phần phễu của buồng tống thất phải do tắc nghẽn của cơ sợi( fibromuscular) tâm thất, hay trong buồng thất phải do các dải cơ bất thường tạo thành thất phải 2 buồng(1). Trong trường hợp thất phải 2 buồng, vị trí của dải cơ có thể làm thay đổi rất nhiều nơi tắc nghẽn và mức độ tắc nghẽn(41). Nó chia thất phải thành 2 buồng: buồng có áp suất cao và buồng có áp suất thấp, vì vậy gây khó khăn cho chẩn đoán chính xác. Hẹp dưới van thường nặng dần lên theo thời gian, do đó thường phát hiện triệu chứng lần đầu tiên ở tuổi trưởng thành(42). Sinh lý bệnh là do tắc nghẽn động học đường thoát thất phải, khác hơn với tắc nghẽn cố định của hẹp van động mạch phổi. Tuy nhiên, kết quả cuối cùng đều là tăng áp lực lên thất phải dẫn đến phì đại thất phải. Khi vẫn còn lỗ thông liên thất, chiều của shunt sẽ phụ thuộc vào vị trí của nó. Khi lỗ thông kết nối với buồng gần áp lực cao, shunt có chiều từ phải sang trái, gây ra thiếu oxy lúc nghỉ hay chỉ khi gắng sức nhẹ. Nếu lỗ thông kết nối với buồng xa áp lực thấp, shunt sẽ có chiều từ trái sang phải.
Biểu hiện lâm sàng giống như các trường hợp hẹp van động mạch phổi, do tắc nghẽn đường thoát thất phải. Bệnh nhân có thể than phiền khó thở, đau ngực và hiếm khi ngất. Do những triệu chứng trên có thể do nhiều bệnh tim mắc phải gây ra, như bệnh động mạch vành, nên cần phải nghi ngờ đến trong khi làm chẩn đoán. Thăm khám lâm sàng có thể nghe tiếng thổi tâm thu vùng động mạch phổi, có thể nghe thô ráp hơn tiếng thổi của hẹp van động mạch phổi do tắc nghẽn động học. Không có tiếng click tống máu giúp phân biệt với hẹp do van động mạch(1). Nếu có phì đại thất phải thì sẽ phát hiện qua khám lâm sàng và ECG. Chẩn đoán thường được thực hiện qua siêu âm tim, phát hiện sự chênh áp động học đường thoát thất phải. Siêu âm tim 2 chiều ở mặt cắt dưới bờ sườn sẽ cho thấy vị trí, hình thái của chỗ hẹp: do hẹp phễu hay do dải cơ phì đại bất thường, hay hình ảnh 2 buồng thất phải. Hình ảnh của van động mạch phổi cũng quan trọng để loại trừ hẹp van kèm theo, doppler màu giúp đánh giá xem có thông liên thất kèm theo không. Nếu siêu âm tim không đủ để chẩn đoán, MRI có thể xác định giải phẫu(43,44). Thông tim có thể được dùng để xác định thất phải có 2 buồng, bằng cách phác họa ra buồng vào áp lực cao và buồng thoát áp lực thấp. Chụp hình mạch máu thất phải có thể cung cấp hình ảnh rất tốt về hẹp đường thoát hay có vách ngăn trong buồng thất phải, mặc dù hiện tại hiếm khi phải cần dùng đến phương pháp này để chẩn đoán.
Điều trị hẹp dưới van động mạch phổi thường phải cần đến phẫu thuật để cắt bỏ một phần phễu hay dải cơ phì đại bất thường. Có những báo cáo áp dụng phương pháp can thiệp qua da như nong bằng bóng(45,46) hay tiêm chích cồn(47), nhưng chúng không có hiệu quả rõ rệt như hẹp van động mạch phổi. Không có nhiều báo cáo theo dõi sau đó, tuy nhiên tiên lượng sau phẫu thuật rất tốt trong các trường hợp hẹp do phì đại cơ vùng phễu (48) hay thất phải 2 buồng(49,50). Hiếm khi phải cần can thiệp lần 2, tuy nhiên bệnh nhân cần được theo dõi dài lâu bởi bác sĩ tim mạch để tầm soát các hậu quả về sau.
HẸP TRÊN VAN ĐỘNG MẠCH PHỔI
Hẹp trên van động mạch phổi đơn độc bẩm sinh, hay hẹp động mạch phổi là bệnh lý rất hiếm ở người lớn. Trẻ em được chẩn đoán bệnh lý này thường đi kèm với hội chứng Williams hay Alagille, và nó thường được thấy trong những bệnh tim bẩm sinh khác, như tứ chứng Fallot. Tuy có thể chẩn đoán bệnh lý hẹp động mạch phổi ngoại vi ở người lớn, nhưng có thể chẩn đoán lầm với các tình trạng bệnh lý thuyên tắc. Triệu chứng bao gồm khó thở và mệt mỏi, các phương pháp cận lâm sàng cho thấy hình ảnh giảm tưới máu phổi và tăng áp lực tâm thu thất phải qua thông tim. Nong bằng bóng hay đặt stent động mạch phổi giúp điều trị hiệu quả.
TRƯỜNG HỢP LÂM SÀNG:
Bệnh nhân được chuyển vào thông tim và tạo hình động mạch phổi do sự chênh áp tăng cao đáng kể và phì đại thất phải. Đo được mức chênh áp qua van động mạch phổi là 80 mm Hg, chụp hình mạch máu phát hiện van động mạch phổi hình vòm, lỗ van nhỏ và hẹp vùng phễu. Thân động mạch phổi giãn rất lớn , đo được 6 cm(hình 3.4). Tạo hình van động mạch phổi thành công sử dụng kỹ thuật bóng đôi. Sau thủ thuật, độ chênh áp qua van tối đa- tối đa( Peak- Peak transvalvular gradient) là 14 mmHg và chênh áp động học đỉnh muộn là 10 mmHg( Hình 3.5). Không có biến chứng xảy ra sau thủ thuật. Bệnh nhân khỏe mạnh không có rối loạn huyết động hay hở van động mạch phổi sau đó 1 năm. Do tỷ lệ vỡ hay bóc tách động mạch phổi khi không có tăng áp phổi là quá thấp nên can thiệp phẫu thuật để điều trị giãn sau hẹp là không cần thiết.
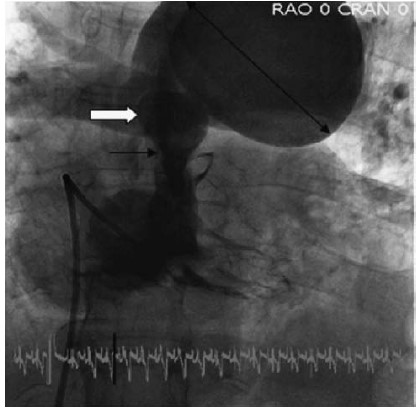
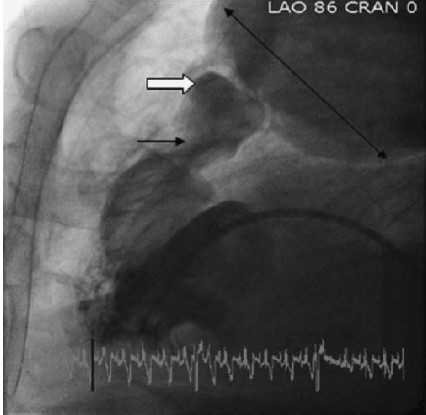
Hình 3.4: Chụp mạch máu đa lát cắt cho thấy hình ảnh hẹp phễu (mũi tên đen), van động mạch phổi hình vòm (mũi tên trắng), và giãn nặng sau chỗ hẹp của động mạch phổi (mũi tên đen kép). ( Courtesy of DR Thomas Ports).
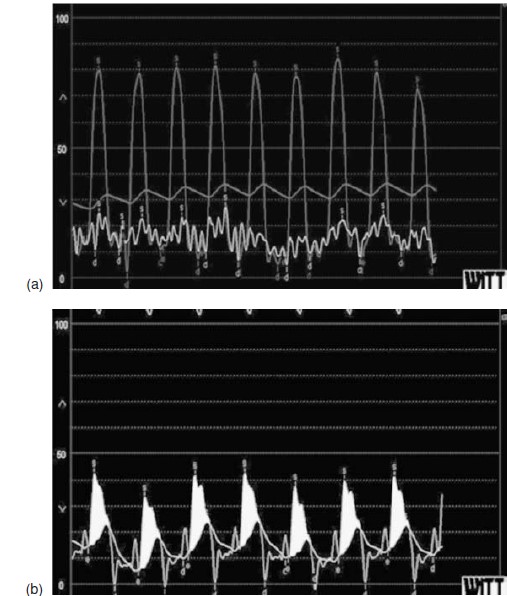
Hình 3.5: Huyết động học (a) trước và (b) sau tạo hình van cho thấy sự giảm đáng kể chênh áp qua van động mạch phổi. ( Courtesy of DR Thomas Ports).
TÓM TẮT:
Hẹp động mạch phổi là một bệnh tim bẩm sinh có thể được phát hiện ở tuổi trưởng thành khi biểu hiện khó thở, đau ngực hay đánh trống ngực. Thêm vào đó, do kết quả quá tốt của điều trị phẫu thuật sửa van hay tạo hình van bằng bóng, nên hầu hết trẻ em sống khỏe đến giai đoạn trưởng thành và cần theo dõi định kỳ bởi bác sĩ tim mạch để phát hiện hẹp tái phát hay hở van động mạch phổi. Siêu âm tim, và gần đây là chụp MRI là phương pháp chẩn đoán không xâm nhập để đánh giá mức độ tắc nghẽn đường thoát và chức năng của thất phải. Tạo hình van bằng bóng hiện nay là phương pháp lựa chọn cho trẻ em và người lớn khi có hẹp van động mạch phổi dạng vòm. Hướng dẫn đề nghị thực hiện các kỹ thuật trên cho người lớn có triệu chứng và có sự chênh áp qua van trên 30 mmHg hay không triệu chứng mà có chênh áp lớn hơn 40 mm Hg. Hẹp dưới van hiếm gặp hơn ở người lớn, điều trị phẫu thuật cho kết quả tốt.
Tài liệu tham khảo:
- Blieden L, Berant M, Zeevi B. Pulmonic stenosis. In: Moller J, Hoffman J, eds. Pediatric Cardiovascular Medicine, 1st edition. Philadelphia: Churchill Livingstone, 2000: 552–66.
- Perloff JK, ed. Congenital pulmonary stenosis. In: The Clinical Recognition of Congenital Heart Disease, 5th edition. Philadelphia: Saunders, 2003:163–86.
- Abrams J. Synopsis of Cardiac Physical Diagnosis, 2nd edition. Boston: Butterworth- Heinemann, 2001:95–101.
- Feigenbaum H, Armstrong W, Ryan T. Feigenbaum’s Echocardiography, 6th edition. Philadelphia: Lippincott,Williams &Wilkins, 1994:356–7, 574–6.
- Davlouros PA, Niwa K,Webb G, et al. The right ventricle in congenital heart disease. Heart 2006;92:i27–38 (suppl 1).
- Baim D, GrossmanW. Grossman’s Cardiac Catheterization, Angiography, and Intervention,
6th edition. Philadelphia: Lippincott,Williams & Wilkins.
- Kan JS, White RI, Mitchell SE, et al. Percutaneous balloon valvuloplasty: a newmethod for treating congenital pulmonary-valve stenosis. N Engl J Med 1982;307:540–2.
- Pepine CJ, Gessner IH, Feldman RL. Percutaneous balloon valvuloplasty for pulmonic valve stenosis in the adult. Am J Cardiol 1982;50:1442–5.
- Chen CR, Cheng TO, Huang T, et al. Percutaneous balloon valvuloplasty for pulmonic stenosis in adolescents and adults. N Engl J Med 1996;335:128–34.
- Fernandes V, Kaluza GL, Zymek PT, et al. Successful balloon valvuloplasty in an adult patient with severe pulmonic stenosis and aneurysmal post-stenotic dilatation. Catheter Cardiovasc Interv 2002;55:376–80.
- Bahl VK, Chandra S,Wasir HS. Pulmonary valvuloplasty using Inoue balloon catheter. Int J Cardiol 1994;45:141–3.
- Lau KW, Hung JS, Wu JJ, et al. Pulmonary valvuloplasty in adults using the Inoue balloon catheter. Catheter Cardiovasc Diagn 1993;29:99–104.
- Al Kasab S, Ribeiro P, Al Zaibag M. Use of a double balloon technique for percutaneous balloon valvotomy in adults. Br Heart J 1987;58:136–41.
- Park JH, Yoon YS, Yeon KM, et al. Percutaneous balloon valvuloplasty with a doubleballoon
technique. Radiology 1987;164:715–8.
- Mullins CE, Nihill MR, Vick GW 3rd, et al. Double balloon technique for dilation of valvular or vessel stenosis in congenital and acquired heart disease. J Am Coll Cardiol 1987;10:107–14.
- Ali Khan MA, Yousef SA, Mullins CE. Percutaneous transluminal balloon pulmonary valvuloplasty for the relief of pulmonary valve stenosis with special reference to double-balloon technique. Am Heart J 1986;112:158–66.ventricular outflow trstruction 9
- Escalera RB 2nd, Chase TJ, Owada CY. Triple-balloon pulmonary valvuloplasty: an advantageous technique for percutaneous repair of pulmonary valve stenosis in the large pediatric and adult patients. Catheter Cardiovasc Interv 2005;66:446–51.
- Hayes CJ, Gersony WM, Driscoll DJ, et al. Second natural history study of congenital heart defects: results of treatment of patients with pulmonic valvar stenosis. Circulation 1993;87:I28–37 (suppl).
- Driscoll DJ, Wolfe RR, Gersony WM, et al. Cardiorespiratory responses to exercise of patients with aortic stenosis, pulmonary stenosis, and ventricular septal defect. Circulation 1993;87:I102–13 (suppl).
- Gersony WM, Hayes CJ, Driscoll DJ, et al. Second natural history study of congenital heart defects: quality of life of patients with aortic stenosis, pulmonary stenosis, or ventricular septal defect. Circulation 1993;87:I52–65 (suppl).
- GersonyWM,Hayes CJ,DriscollDJ, et al. Bacterial endocarditis in patients with aortic stenosis, pulmonary stenosis, or ventricular septal defect. Circulation 1993;87:I121–6 (suppl).
- Wolfe RR, Driscoll DJ, Gersony WM, et al. Arrhythmias in patients with valvar aortic stenosis, valvar pulmonary stenosis, and ventricular septal defect: results of 24-hour ECG monitoring. Circulation 1993;87:I89–101 (suppl).
- Personal communication, Dr. Thomas Ports; University of California, San Francisco.
- Roos-Hesselink JW, Meijboom FJ, Spitaels SEC, et al. Long-term outcome after surgery for pulmonary stenosis (a longitudinal study of 22–33 years). Eur Heart J 2006;27:482–8.
- Earing MG, Connolly HM, Dearani JA, et al. Long-term follow-up of patients after surgical treatment for isolated pulmonary valve stenosis. Mayo Clin Proc 2005;80:871–6.
- Al Kasab S, Ribeiro P, Al Zaibag M, et al. Percutaneous double balloon pulmonary valvotomy in adults: one- to two-year follow-up. Am J Cardiol 1988;62:822–4.
- Sievert H, Kober G, Bussman WD, et al. Long-term results of percutaneous pulmonary valvuloplasty in adults. Eur Heart J 1989;10:712–7.
- Herrmann HC, Hill JA, Krol J, et al. Effectiveness of percutaneous balloon valvuloplasty in adults with pulmonic valve stenosis. Am J Cardiol 1991;68:1111–3.
- Kaul UA, Singh B, Tyagi S, et al. Long-term results after balloon pulmonary valvuloplasty in adults. Am Heart J 1993;126:1152–5.
- Sadr-Ameli MA, Sheikholeslami F, Firoozi I, et al. Late results of balloon pulmonary valvuloplasty in adults. Am J Cardiol 1998;82:398–400.
- Teupe CH, BurgerW, Schrader R, et al. Late (five to nine years) follow-up after balloon dilation of valvular pulmonary stenosis in adults. Am J Cardiol 1997;80:240–2.
- Lip GY, Singh SP, de Giovanni J. Percutaneous balloon valvuloplasty for congenital pulmonary valve stenosis in adults. Clin Cardiol 1999;22:733–7.
- Fawzy ME, HassanW, Fadel BM, et al. Long-term results (up to 17 years) of pulmonary balloon valvuloplasty in adults and its effects on concomitant severe infundibular stenosis and tricuspid regurgitation. Am Heart J. 2007;153:433–8.
- Sherman W, Hershman R, Alexopoulos D, et al. Pulmonic balloon valvuloplasty in adults. Am Heart J 1990;119:186–90.
- Elkayam U, Bitar F. Valvular heart disease and pregnancy. Part I. Native valves. J Am Coll Cardiol 2005;46:223–30.
- Hameed AB, Goodwin TM, Elkayam U. Effect of pulmonary stenosis on pregnancy outcomes: a case-control study. Am Heart J 2007;154:852–4.0 Adult Congenital Heart Disease
- Drenthen W, Pieper PG, Roos-Hesselink JW, et al. Non-cardiac complications during pregnancy in women with isolated congenital pulmonary valvar stenosis. Heart 2006;92:1838–43.
- Loya YS, Desai DM, Sharma S. Mitral and pulmonary balloon valvotomy in pregnant patients. Indian Heart J 1993;45:57–9.
- Bonow RB, Carabello BA, Chatterjee K, et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease): developed in collaboration with the Society of Cardiovascular Anesthesiologists: endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons.Circulation 2006;114:e84–231.
- WilsonW,Taubert KA, Gewitz M, et al. Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on CardiovascularDisease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007;116:1736–54.
- Rowland TW, Rosenthal A, Castaneda AR. Double-chamber right ventricle: experience with 17 cases. Am Heart J 1975;89:455–62.
- McElhinney DB, Chatterjee KM, Reddy VM. Double-chambered right ventricle presenting in adulthood. Ann Thorac Surg 2000;70:124–7.
- Ibrahim T, Dennig K, Schwaiger M, et al. Assessment of double chamber right ventricle by magnetic resonance imaging. Circulation 2002;105:2692–3.
- Sato Y, Komatsu S, Matsuo S, et al. Isolated subvalvular pulmonary stenosis: depiction at whole heart magnetic resonance imaging. Int J Cardiovasc Imaging 2007;23:49–52.
- Chandrashekhar YS, Anand IS, Purshottam LW. Balloon dilatation of double-chamber right ventricle. Am Heart J 1990;120:1234–6.
- Chandrashekhar YS, Anand IS. Balloon dilatation of primary infundibular stenosis of the right ventricular outflow tract. Am Heart J 1992;124:1385–6.
- Park SJ, Lee CW, Hong MK, et al. Transcoronary alcohol ablation of infundibular hypertrophy in patients with idiopathic infundibular pulmonic stenosis. Am J Cardiol 1997;80:1514–6.
- Shyu KG, Tseng CD, Chiu IS, et al. Infundibular pulmonic stenosis with intact ventricular septum: a report of 15 surgically corrected patients. Int J Cardiol 1993;41:115–21.
- Kveselis D, Rosenthal A, Ferguson P, et al. Long-term prognosis after repair of doublechamber right ventricle with ventricular septal defect. Am J Cardiol 1984;54:1292–5.
- Hachiro Y, Takagi N, Koyanagi T, et al. Repair of double-chambered right ventricle: surgical results and long-term follow-up. Ann Thorac Surg 2001;72:1520–2.
- Kreutzer J, Landzberg MJ, Preminger TJ, et al. Isolated peripheral pulmonary artery stenosis in the adult. Circulation 1996;93:1417–23.
- Rothman A, Levy DJ, Sklansky MS, et al. Balloon angioplasty and stenting of multiple intralobar pulmonary arterial stenoses in adult patients. Catheter Cardiovasc Interv 2003;58:252–60.

Để lại bình luận
Bạn cần phải đăng nhập để đăng bình luận.