Barbara J. Deal
Người dịch: BS Minh
Ca lâm sàng
Bệnh nhân nam 24 tuổi, tiền căn phẫu thuật đóng thông liên thất và cắt bỏ phần phễu động mạch phổi bị hẹp và xẻ van động mạch phổi năm 14 tuổi. Năm 20 tuổi, bệnh nhân đã bắt đầu có những cơn hồi hộp và có 2 cơn choáng gần ngất khi đang lái xe, có liên quan với tăng nhịp tim. Khả năng gắng sức cũng giảm trong vài năm gần đây. Bệnh nhân đã vào viện kiểm tra và ghi nhận được những cơn nhịp nhanh thất trên máy theo dõi ECG từ xa.
Thăm khám tim mạch ghi nhận tăng động vùng thất phải, với rung miu. Nhịp tim đều với tiếng T2 tách đôi rộng, âm thổi tâm thu 4/6 và âm thổi tâm trương 1-2/6 ở bờ trái xương ức phần cao. Gan hơi to.
ECG nhịp xoang kèm block nhánh phải không hoàn toàn, với khoảng QRS 110ms.
Siêu âm tim cho thấy tắc nghẽn buồng tống thất phải mức độ trung bình, hở van động mạch phổi trung bình và dãn nhẹ thất phải.
ECG gắng sức ghi nhận ngoại tâm thu thất xuất hiện nhiều khi khởi đầu gắng sức, tiến triển thành nhịp nhanh thất đơn dạng kéo dài ở phút thứ 6 (Hình 15.1), nhịp nhanh thất với tần số 260 l/ph, gây ra chóng mặt, trắc nghiệm gắng sức phải ngưng lại. Lượng O2 đỉnh tiêu thụ 18 ml/kg/phút. Hình thái nhịp nhanh thất là dạng block nhánh trái, trục hướng xuống dưới.
Khảo sát điện sinh lý được thực hiện, nhưng không kích được cơn nhịp nhanh nhĩ cũng như thất nào bằng phương pháp kích thích tim theo chương trình.
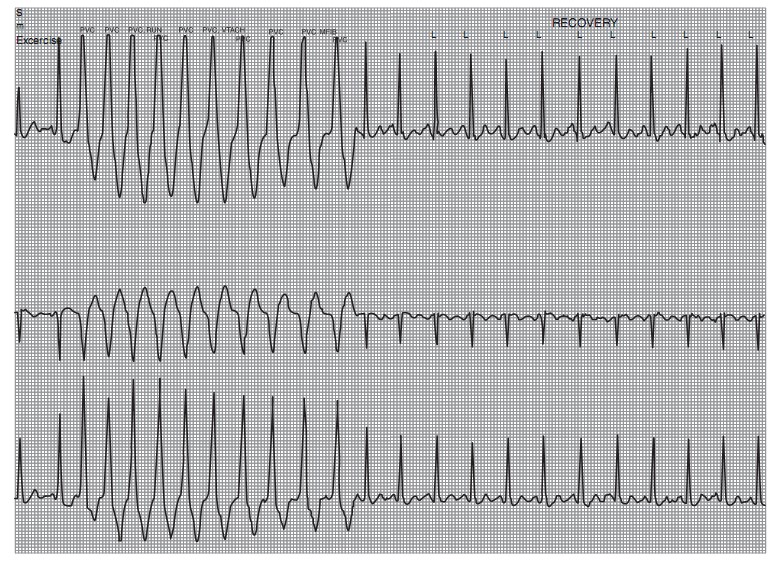
Hình 15.1: Nhịp nhanh thất khi làm ECG gắng sức
Mở đầu
Rối loạn nhịp là di chứng lâu dài thường gặp nhất của bệnh tim bẩm sinh, xảy ra ở 18-20% người lớn bị tim bẩm sinh. Hơn nữa, loạn nhịp cũng là nguyên nhân gây đột tử thường gặp nhất của bệnh tim bẩm sinh ở người lớn với tần suất gấp 2 lần so với đột tử do suy tim [1]. Rối loạn nhịp (RLN) xảy ra như là một phần của tiến trình tự nhiên của bệnh tim ở cả bệnh nhân không được phẫu thuật hoặc đã được phẫu thuật với những hình thái phức tạp của bệnh tim.
Thảo luận về RLN trong bệnh tim bẩm sinh thường xoay quanh 3 vấn đề:
– Điều trị và quản lý lâu dài bệnh nhân đã có RLN
– Xác định nguy cơ đột tử do RLN
– Can thiệp để làm giảm nguy cơ xảy ra RLN và cố gắng làm giảm tần suất xảy ra loạn nhịp.
Điều trị bệnh nhân đã có loạn nhịp
Tần suất RLN liên quan với bệnh tim bẩm sinh tăng dần theo tuổi, khoảng 22% lúc 40 tuổi và 40 % lúc 55 tuổi [1], tóm tắt ở bảng 15.1. Hơn 40% bệnh nhân với bệnh Ebstein; phẫu thuật Fontan sửa chữa nhĩ – phổi; phẫu thuật hoán vị đại động mạch chuyển đổi ở tầng nhĩ.
Bảng 15.1 Tần suất của loạn nhịp xảy ra muộn trong bệnh tim bẩm sinh
|
Hình thái bệnh lý |
Tần suất loạn nhịp |
|
Thông liên nhĩ |
5-40% nhịp nhanh trên thất |
|
Bệnh Ebstein |
40-80% nhịp nhanh trên thất |
|
Tâm thất độc nhất đã PT Fontan nhĩ phổi |
30-60% nhịp nhanh trên thất |
|
Hoán vị đại động mạch đã chuyển đổi ở tầng nhĩ |
30-50% nhịp nhanh trên thất |
|
Hoán vị đại động mạch có sửa chữa bẩm sinh |
20-30% bloc nhĩ thất |
|
Tứ chứng Fallot |
7% nhanh thất, 30% NNTT |
|
Phẩu thuật lại van 3 lá |
35% nhịp nhanh trên thất |
|
Thông liên thất |
< 2% NNTT, nhanh thất |
Phẫu thuật thông liên nhĩ ở tuổi trưởng thành thường xuất hiện nhịp nhanh trên thất. Tần suất RLN cũng cao hơn trong những trường hợp phải phẫu thuật lại khi có luồng thông tồn lưu gây rối loạn huyết động, dẫn đến quan niệm RLN như là vấn đề “cơ – điện học” mà lúc đầu được mô tả ở những bệnh nhân tứ chứng Fallot đã được phẩu thuật sửa chữa. Quan niệm này cũng được áp dụng cho những hình thái bệnh tim khác. Điều này nhấn mạnh sự cần thiết là ở bất cứ bệnh nhân bị bệnh tim bẩm sinh nào có rối loạn nhịp cũng nên tìm kiếm kỹ lưỡng tình trạng rối loạn huyết động đang hiện hữu hơn là chỉ đơn giản nhắm đến chính tình trạng loạn nhịp mà thôi. Mặc dù nhịp nhanh thất thường nhận được sự quan tâm nhiều hơn như là một RLN thường gặp nhất sau phẫu thuật ở bệnh nhân tứ chứng Fallot, do việc gia tăng nguy cơ đột tử từ RLN này; tần suất nhịp nhanh trên thất là hình thái loạn nhịp thường gặp nhất ở bệnh tim bẩm sinh với tỷ lệ ít nhất gấp 4 lần hơn nhịp nhanh thất và cũng làm tăng có ý nghĩa tật bệnh, như tỉ lệ suy tim, đột quỵ.
Bất cứ việc bàn luận nào về kiểm soát loạn nhịp đều cần phải tìm hiểu bản chất của nhiều cơ chế khác nhau của loạn nhịp, đặc biệt nhiều loại nhịp nhanh trên thất khác nhau. Những bệnh tim bẩm sinh khác nhau thường liên quan với những dạng rối loạn nhịp khác nhau (tóm tắt trong bảng 15.2). Nhịp nhanh trên thất liên quan tới sự hiện diện của đường phụ, hoặc là đường phụ hiện (liên quan với hội chứng WPW) hoặc là đường phụ ẩn, thường hay có hướng dẫn truyền nhĩ thất qua nút nhĩ thất và dẫn truyền thất nhĩ thì sử dụng đường phụ (được gọi là nhịp nhanh hỗ tương xuôi chiều; hình 15.2). Ít gặp hơn, vòng vào lại gây nhịp nhanh có thể có dẫn truyền nhĩ thất qua đường phụ và dẫn truyền thất nhĩ qua nút nhĩ thất (nhịp nhanh hỗ tương ngược chiều) hay một tình trạng loạn nhịp nhĩ như là rung nhĩ thì có thể được dẫn truyền nhanh trên đường phụ xuống tâm thất (nhịp nhanh nhĩ tiền kích thích). Giống như đường phụ là một bất thường bẩm sinh với sự tồn tại của mô dẫn truyền ở vòng nhĩ thất, những thương tổn với bất thường của van nhĩ thất thường liên quan nhiều hơn với nhịp nhanh trên thất (Van 3 lá trong bất thường Ebstein, trong một số bệnh khác).
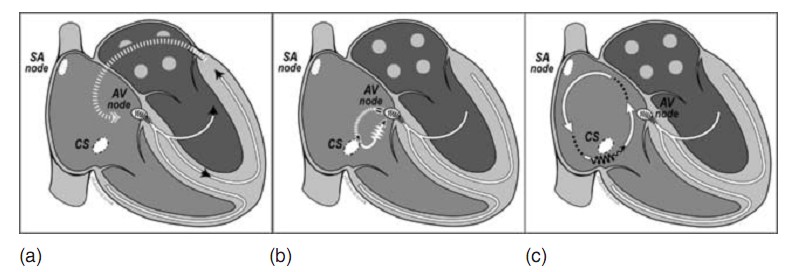
Hình 15.2: Cơ chế của nhịp nhanh trên thất:
- Nhịp nhanh do vòng vào lại nhĩ thất thể orthodromic
- Nhịp nhanh do vòng vào lại nhĩ thất
- Nhịp nhanh nhĩ do vòng vào lại lớn
Bảng 15.2: Loạn nhịp liên quan đến những hình thái đặc biệt của Tim bẩm sinh
|
Rối loạn nhịp |
Bệnh tim bẩm sinh |
|
Nhịp nhanh trên thất -Qua trung gian đường phụ |
Ebstein Thông liên nhĩ Hoán vị đại ĐM có sửa chữa bẩm sinh Bệnh cơ tim phì đại |
|
-Vòng vào lại ở tâm nhĩ |
Thông liên nhĩ Tâm thất độc nhất, với phẫu thuật sửa chữa Fontan nhĩ phổi Sửa chữa hoán vị đại ĐM ở tầng nhĩ (PP Mustard/Senning) Kênh nhĩ thất toàn phần. Tứ chứng Fallot Nối liền bất thường tĩnh mạch phổi toàn phần |
|
-Vòng vào lại tại nút nhĩ thất |
Sữa chữa hoán vị đại động mạch ở tầng nhĩ (PP Mustard / Senning) |
|
|
Bệnh lý tắc nghẽn đường thoát thất trái |
|
-Rung nhĩ |
Bệnh lý van 2 lá Bất thường van 3 lá trong Ebstein Tâm thất độc nhất, đặc biệt trong không lỗ van 3 lá Thông liên nhĩ Tứ chứng Fallot Bệnh cơ tim phì đại Hội chứng Eisenmenger |
|
Nhịp nhanh thất |
Tứ chứng Fallot Thông liên thất Hẹp van ĐM chủ |
|
Rung thất |
Hẹp van ĐM chủ Bệnh cơ tim phì đại Sửa chữa hoán vị đại động mạch ở tầng nhĩ (PP Mustard / Senning) |
|
Nhịp chậm xoang |
Sửa chữa hoán vị đại động mạch ở tầng nhĩ (PP Mustard / Senning) Tâm thất độc nhất: PT Fontan nhĩ-phổi Thông liên nhĩ Kênh nhĩ thất toàn phần Nối liền bất thường tĩnh mạch phổi |
|
Bloc nhĩ thất |
Chuyển vị đại ĐM có sửa chữa bẩm sinh Tứ chứng Fallot Thông liên nhĩ Kênh nhĩ thất toàn phần |
Ngược lại, nhịp nhanh do vòng vào lại nút nhĩ thất liên quan đến sự khác nhau về chức năng dẫn truyền trên đường nhanh và đường chậm của nút nhĩ thất, hay ít gặp hơn, là do có sự tham gia của nút nhĩ thất liên quan với hội chứng chuyển vi (heterotaxy syndrome). Trong loạn nhịp nhĩ nguyên phát, vòng vào lại gây ra nhịp nhanh được xác định là ở trong mô của tâm nhĩ, sự dẫn truyền xuống tâm thất không quyết định việc duy trì tình trạng nhịp nhanh; ví dụ như nhịp nhanh nhĩ do vòng vào lại, cuồng nhĩ, và rung nhĩ. Bản chất của loạn nhịp nhĩ tiên phát thường do bất thường bẩm sinh của sự sắp xếp các dãy sợi cơ trong nhĩ, sự tạo nên những vòng vào lại như là hậu quả của việc tạo những đường rạch trên cơ tim hoặc miếng vá khi phẫu thuật tim, hoặc do hậu quả của sự kéo dãn và sợi hóa do có bất thường huyết động .Điều trị cấp thời và bản chất tự nhiên của nhiều cơ chế khác nhau của nhịp nhanh trên thất thì khác nhau thực sự.
Nhịp nhanh thất liên quan đến bệnh tim bẩm sinh thường xuất hiện trong các trường hợp sau mổ tim mà có xẻ tâm thất hoặc có miếng vá trên tâm thất như tứ chứng Fallot, thông liên thất, thân chung động mạch. Vòng vào lại được tạo thành do có sự dẫn truyền chậm hình thành giữa vết cắt hay miếng vá và một lỗ giải phẫu, ví dụ vùng giữa miếng vá ở vách liên thất và buồng tống thất phải trong tứ chứng Fallot. Các tổn thương làm nghẽn buồng tống thất trái dẫn đến phì đại cơ tim, hậu quả là thiếu máu cục bộ dưới nội mạc sẽ tạo thành các mảng sợi hóa. Những yếu tố dự báo cho sự xuất hiện nhịp nhanh thất bao gồm tuổi lớn ở thời điểm phẫu thuật, thời gian phẫu thuật kéo dài, tăng áp lực trong thất phải do hẹp buồng tống thất phải tồn lưu, dãn thất phải do bệnh lý van động mạch phổi, giảm phân suất tống máu, QRS trên 180ms. [3-6]
Sự hiện diện của một rối loạn nhịp trên bệnh tim bẩm sinh gây rối loạn huyết động và nguy cơ đột tử nên đòi hỏi điều trị phải nhanh chóng. Những bệnh lý bẩm sinh mà khi kết hợp với rối loạn nhịp có nguy cơ cao nhất bao gồm bệnh tim bẩm sinh có tím, bệnh Ebstein có kèm shunt ở tầng nhĩ, tâm thất độc nhất, hoán vị đại động mạch có chuyển đổi ở tầng nhĩ, bệnh cơ tim phì đại và các tổn thương gây tắc nghẽn đường thoát tâm thất. Sự xuất hiện của một rối loạn nhịp kéo dài trên những bệnh nhân này cần được xem như là một tình huống đe dọa tính mạng và cần phải điều trị khẩn cấp.
Nguyên tắc cơ bản của điều trị khẩn cấp RLN trên bệnh tim bẩm sinh là nhanh chóng nhận ra có RLN, đánh giá tình trạng huyết động, nhận diện các yếu tố nguy cơ cao đã kể ở trên, chẩn đoán cơ chế rối loạn nhịp. Việc điều trị cấp thời thì hoặc là kiểm soát tần số thất hoặc cắt cơn nhịp nhanh. Ở những bệnh nhân bệnh tim bẩm sinh, việc nhận ra vấn đề RLN thường khó thăn do các triệu chứng hiện diện một cách khá mơ hồ. Bệnh nhân thay vì than phiền về các triệu chứng hồi hộp hay tim đập nhanh, lại thường than phiền về tình trạng nặng lên của suy tim, mệt mỏi, đau bụng, ói, chóng mặt xây xẩm, ngất. Sự hiện diện của nhịp tim nhanh trên 100 l/ph ở một bệnh nhân lớn tuổi có tiền căn phẫu thuật tim bẩm sinh nên được nghi ngờ là một cơn nhịp nhanh cho đến khi có bằng chứng chứng minh ngược lại. Sự hiện diện của Block nhĩ thất 2:1 hay ở mức cao hơn nữa có thể gây khó khăn cho việc nhận ra một cơn nhịp nhanh nhĩ. Tương tự như vậy, tình trạng thiếu biến động của nhịp tim đôi khi chỉ ra một trường hợp nhịp nhanh nhĩ, đặc biệt khi có sự hiện diện của suy tim sung huyết. Nhịp nhanh kéo dài hơn 48 giờ hoặc không rõ thời gian làm tăng nguy cơ hình thành huyết khối và tiềm tàng khả năng thuyên tắc khi tiến hành shock điện chuyển nhịp, điều này đòi hỏi vai trò của siêu âm tim qua thực quản. Ở một số bệnh nhân chắn chắn có nguy cơ cao, rối loạn huyết động xảy ra trong cơn nhịp nhanh có thể nguy hiểm hơn nguy cơ thuyên tắc và khó quyết định thì shock điện ngay là cần thiết, bất chấp nguy cơ huyết khối. Trong trường hợp bệnh nhân ổn định mà phát hiện được có huyết khối trong buồng tim thì có thể dùng kháng đông ít nhất 3 tuần lễ, kiểm soát tần số thất bằng thuốc sau đó có thể thử shock điện chuyển nhịp.
Điều trị nhịp nhanh bắt đầu bằng quyết định chỉ kiểm soát tần số thất hay cần thiết phải chuyển nhịp. Trong nhiều trường hợp thì kiểm soát tần số thất là bước đầu tiên sau đó mới chuyển nhịp. Các phương pháp điều trị bao gồm thuốc, máy tạo nhịp và chuyển nhịp trực tiếp. Kiểm soát nhịp bằng thuốc ức chế kênh Cacium hay Esmolol là phương pháp tạm thời để cải thiện huyết động trong khi chờ đợi cho một điều trị vĩnh viễn. Hai nguy cơ tiềm tàng khi trì hoãn chuyển nhịp là làm suy tim nặng hơn và việc sử dụng một số loại thuốc có thể làm kéo dài đoạn QT dẫn đến rối loạn nhịp thất. Chuyển nhịp bằng thuốc có thể tiến hành với Adenosine, Ibutilide, Amiodarone, Procainamide hay Lidocain tùy thuộc vào cơ chế gây ra RLN [7,8]. Kích thích nhĩ vượt tần số hoặc qua đường tĩnh mạch hoặc qua điện cực thực quản cũng là một phương pháp chuyển nhịp hiệu quả với các RLN do vòng vào lại ở tầng nhĩ. Shock điện chuyển nhịp là phương pháp được lựa chọn trong trường hợp huyết động không ổn định hoặc thất bại với điều trị dùng thuốc ban đầu. Việc đặt miếng dán shock điện ở phía trước và phía sau tỏ ra có hiệu quả hơn trong trường hợp rối loạn nhịp nhĩ mà có tâm nhĩ quá to (như trường hợp tâm thất độc nhất) Chú ý đổi bên miếng điện cực dán đối với bệnh nhân có tim bên phải.
Sau khi chuyển nhịp thành công, điều trị nội khoa tối ưu suy tim sung huyết và ổn định huyết động là rất cần thiết đặc biệt là trong trường hợp RLN là hậu quả của một tình trạng rối loạn huyết động lâu dài. Do đặc điểm tim đập nhanh trên bệnh nhân bệnh tim bẩm sinh, tái phát loạn nhịp thường cao làm nặng tật bệnh. Ở các bệnh nhân với rối loạn nhịp nhĩ cần phải dùng kháng đông lâu dài để làm giảm thiểu nguy cơ tạo huyết khối trong buồng nhĩ. Các thuốc ức chế dẫn truyền qua nút nhĩ thất (ức chế beta, ức chế Ca, Digoxin) và/hoặc các thuốc chống loạn nhịp có thể dùng lâu dài tùy thuộc vào tình trạng huyết động, tần số cơn và khả năng chịu đựng của bệnh nhân. Sotalol và Dofetilide cho thấy hiệu quả trong điều trị nhịp nhanh nhĩ [9]. Amiodarone cũng cho thấy hiệu quả trong việc làm giảm số cơn tái phát nhưng đồng thời cũng làm tăng nguy cơ xảy ra các tác dụng phụ trên tuyến giáp, gan, phổi [10]. Vì lý do này, việc sử dụng Amiodarone lâu dài nên được hạn chế, dùng liều thấp nhất có hiệu quả và theo dõi sát các tác dụng phụ.
Bệnh nhân với tình trạng huyết động cho phép và nhịp nhanh nhĩ có thể điều trị bằng cắt đốt điện sinh lý với tỉ lệ thành công khoảng 50 – 85% [11]. Với loạn nhịp nhĩ, cắt đốt điện sinh lý đặc biệt có hiệu quả trong trường hợp sửa chữa tầng nhĩ hoán vị đại động mạch, hoặc các tổn thương không phức tạp như sửa chữa thông liên nhĩ, thông liên thất [12,13]. Hiệu quả tuyệt vời của cắt đốt điện sinh lý đã được báo cáo bởi nhiều tác giả [11,14].
Khi có rối loạn huyết động hoặc các bệnh nhân có tâm nhĩ phì đại hoặc dãn rộng quá mức, như trường hợp phẫu thuật Fontan nối tâm nhĩ- phổi, thường có sự hiện diện của nhiều vòng vào lại nên tỉ lệ tái phát sau cắt đốt là hơn 60% [15]. Hơn nữa, ở những bệnh nhân này cắt đốt một vùng rộng có thể gây ra di chứng rung nhĩ hoặc làm xấu hơn tình trạng huyết động. Ở các bệnh nhân trải qua phẫu thuật Fontan, cần thiết phải đánh giá chức năng bằng các trắc nghiệm gắng sức và đánh giá tình trạng chuyển hóa bao gồm chức năng gan, albumine máu để phát hiện sớm bệnh lý một gây mất protein, là những bổ sung quan trọng thêm cho siêu âm tim và thông tim để quyết định thời điểm tiến hành thủ thuật. Kích nhịp chống nhịp chậm (máy tạo nhịp) cũng có ý nghĩa làm giảm tần số cơn nhịp nhanh tái diễn, đặc biệt ở những bệnh nhân sửa chữa tầng nhĩ trong hoán vị đại động mạch, cho phép sử dụng các thuốc chống loạn nhịp mà không lo ngại làm chậm nhịp trầm trọng [16]. Ở những bệnh nhân có nguy cơ cao đột tử như sửa chữa hoán vị đại động mạch, ICD cũng cần xem xét chỉ định trước khi đặt một máy tạo nhịp.
Can thiệp phẫu thuật để cải thiện huyết động bằng cách phối hợp phẫu thuật điều trị RLN và đặt máy tạo nhịp đã cho thấy hiệu quả và tỉ lệ thành công cao trên một số bệnh nhân chọn lọc với nhịp nhanh nhĩ hay rung nhĩ [17]. Ở bệnh nhân đã làm phẫu thuật Fontan trước đây với phương pháp nhĩ-phổi hay tạo đường nối bên, trung tâm của chúng tôi và một số trung tâm khác đã báo cáo về kết quả của phẫu thuật chuyển sang nối tắt ngoài tim tĩnh mạch chủ với động mạch phổi toàn phần, kết hợp với phẫu thuật điều trị RLN và đặt máy tạo nhịp cho hơn 175 bệnh nhân [18-21]. Tử vong khi phẫu thuật ít hơn 1% mặc dù có khoảng 7% phải ghép tim sau đó[18]. Trên bệnh nhân có vòng vào lại lớn ở tâm nhĩ phải, phẫu thuật maze hoặc maze biến đổi đã cho thấy làm giảm tỉ lệ tái phát hơn 10% sau 4 năm theo dõi [18, 22]. Áp dụng phẫu thuật Maze vào điều trị rung nhĩ, chúng tôi không ghi nhận trường hợp nào tái phát nhưng có khoảng 15-20% chuyển thành nhịp nhanh nhĩ tái diễn. Tuy nhiên nhịp nhanh nhĩ này có khuynh hướng đáp ứng tốt với cắt cơn bằng tạo nhịp vượt tần số hoặc sử dụng thuốc chống RLN. Phẫu thuật sửa chữa RLN đòi hỏi sự chọn lọc bệnh nhânvà đánh giá tiền phẫu kĩ lưỡng. Những bệnh nhân suy đa cơ quan, suy tim nặng (không do nhịp nhanh, thuốc chữa loạn nhịp, hoặc tổn thương huyết động sửa chữa được), hay bệnh lý ruột gây mất protein không phải là đối tượng tốt cho phẫu thuật mà nên xem xét chỉ định ghép tim.
Việc tiếp tục điều trị bệnh nhân sau khi qua giai đoạn cấp đòi hỏi những phương pháp chuyên sâu hơn. Những bệnh nhân có tổn thương tắc nghẽn hay trào ngược có ý nghĩa cần thiết phải can thiệp phẫu thuật sửa chữa, bệnh nhân có suy chức năng thất trái nặng thì nên xem xét chỉ định điều trị tái đồng bộ tim (CRT) hoặc ghép tim. Cắt đốt điện sinh lý cho các trường hợp nhịp nhanh thất có huyết động ổn định có tỉ lệ thành công gần 60-75% [23], tuy nhiên do nguy cơ tái phát , đặt máy phá rung cấy được (ICD) cũng là cần thiết. Cắt đốt điện sinh lý trong khi phẫu thuật cũng hợp lý cho các trường hợp đã định vị chính xác vị trí ổ tạo nhịp trước phẫu thuật, tuy nhiên tỉ lệ thành công đối với nhịp nhanh thất chỉ khoảng 50-60%, vì vậy cấy ICD được ưa chuộng hơn. Nếu chưa định vị được vòng vào lại thì phương pháp này không được khuyến cáo, do nguy cơ loạn nhịp nguy hiểm tính mạng nếu cắt đốt theo qui ước (không rõ vòng vào lại).
Nguy cơ đột tử do rối loạn nhịp tim
Đột tử xảy ra sau sửa chữa các dị tật tim bẩm sinh vào khoảng 1/1000 bệnh nhân năm, nguy cơ tăng dần với thời gian sau phẫu thuật [26-28]. Các trường hợp tử vong muộn do bệnh lý tim mạch trên những bệnh nhân có bệnh tim bẩm sinh vào khoảng 65-75% [28,29] và đột tử do tim xảy ra khoảng 22-26% [26,28,29]. Đột tử do loạn nhịp tim chiếm 52-84% [26,28,29], tiếp theo là do suy tim, cơn tăng áp phổi, bóc tách động mạch chủ và nhồi máu cơ tim. Hẹp động mạch chủ, Hẹp eo động mạch chủ, Hóan vị đại động mạch, Tứ chứng Fallot là những bệnh lý có nguy cơ cao nhất gây đột tử do loạn nhịp, chiếm khoảng 90% các trường hợp đột tử [26]. Bệnh Ebstein, Tâm thất độc nhất, Thông liên thất, Kênh nhĩ thất cũng có nguy cơ đột tử. Trong trường hợp đột tử do loạn nhịp, người ta ghi nhận có cả rối loạn nhịp nhanh và rối loạn nhịp chậm; loạn nhịp thất chiếm phân nửa trường hợp, loạn nhịp chậm chiếm 20%. [1,26]
Khoảng 60% bệnh nhân có bệnh tim bẩm sinh đột tử đã trải qua phẫu thuật sửa chữa dị tật [1]. Bệnh cơ tim phì đại có nguy cơ đột tử do loạn nhịp dù chưa được phẫu thuật, yếu tố nguy cơ bao gồm: kiểu gen, độ dày vách liên thất, mức độ hẹp buồng tống thất trái, tiền sử gia đình có người đột tử, có nhịp nhanh thất trên monitor, tụt huyết áp khi gắng sức và tiền sử có ngất [30,32]. Trên người lớn, y văn có khuyến cáo chỉ định đặt Máy phá rung cấy được (ICD) dựa trên độ dày của vách liên thất [32]. Ở bệnh nhân đã phẫu thuật, rối loạn huyết động, thất phải đóng vai trò tuần hoàn hệ thống, rối loạn nhịp trên thất hoặc thất góp phần quyết định nguy cơ đột tử. Rối loạn huyết động như hở phổi nặng, nghẽn buồng tống thất, tắc nghẽn động mạch vành, tắc nghẽn ống dẫn, và rối loạn chức năng thất làm tăng nguy cơ đột tử. Như vậy, phẫu thuật hoặc can thiệp sửa chữa sớm sẽ làm giảm các rối loạn huyết động, có thể là một yếu tố quan trọng giảm nguy cơ đột tử [33]. Rối loạn huyết động lâu dài là rối loạn chức năng cả hai thất, sự hình thành các mảng sẹo điện học do cơ tim bị kéo căng, sợi hóa, tăng áp; các yếu tố đó tiềm ẩn nguy cơ loạn nhịp.
Nguy cơ đột tử bao gồm: rối loạn chức năng tâm thất, tăng bệnh nhân (>491pg/ml), tim to (tỉ lệ tim/lồng ngực >0.6), phức bộ QRS dãn rộng (>180ms), QT thay đổi trên 60ms so với mức bình thường, tiền sử có loạn nhịp, ngất, ngưng tim được cứu sống [3, 34-37]. Các bất thường trên điện tâm đồ, theo dõi điện tâm đồ 24 giờ cũng góp phần xác định nguy cơ đột tử. Trong theo dõi của Garson, 57% bệnh nhân đột tử có bằng chứng rối loạn nhịp tim trên monitor trong 1 năm trước đó [6]. Tương tự, sự xuất hiện của ngoại tâm thu thất, hoặc số lượng ngoại tâm thu thất tăng dần trên Holter ECG có thể là chỉ điểm biến đổi huyết động cần can thiệp, không phải là điều trị trực tiếp giảm số ngoại tâm thu.
Vai trò của khảo sát điện sinh lý trong việc xác định nguy cơ đột tử vẫn đang còn nghiên cứu [38]. Khảo sát điện sinh lý giúp định hướng điều trị cho những bệnh nhân loạn nhịp kéo dài hoặc có triệu chứng như ngất. Các dữ liệu này được ngoại suy từ việc tiến hành các kích thích thất khi khảo sát điện sinh lý ở bệnh nhân không có triệu chứng, xác định loạn nhịp kéo dài hay không kéo dài, tình trạng huyết động, và mức độ nguy cơ loạn nhịp liên quan đến từng tổn thương khác nhau của dị tật tim bẩm sinh. Các nghiên cứu cho thấy giá trị tiên lượng của Khảo sát Điện sinh lý được tiến hành trên những bệnh nhân có triệu chứng, có loạn nhịp tim, và/hoặc rối loạn huyết động, sẽ thiên lệch khi áp dụng cho nhóm bệnh nhân không triệu chứng, không có loạn nhịp và huyết động ổn định. Tuy nhiên, đối với nhóm nguy cơ cao như bệnh nhân có sửa chữa tầng nhĩ trong Hoán vị đại động mạch và Tứ chứng Fallot/Thất phải hai đường ra/Không lỗ van Động mạch phổi, hiện có nghiên cứu đa trung tâm xác định lợi ích của các tầm soát xâm nhập. Bệnh nhân có tiền sử rối loạn nhịp thất kéo dài hoặc ngưng tim thường được chỉ định đặt máy phá rung cấy được, thậm chí sau khi đã cắt đốt điện sinh lý hoặc can thiệp phẫu thuật. Việc thực hiện kích thích thất để xác định nguy cơ loạn nhịp ở những bệnh nhân không có rối loạn nhịp thất, không có ngưng tim trước khi phẫu thuật vì rối loạn huyết động ngày càng tăng. Huyết động trước phẫu thuật ổn định thường sẽ giảm được nguy cơ rối loạn nhịp thất sau phẫu thuật. Một tiếp cận khác đó là khảo sát lại những bệnh nhân này sau phẫu thuật trước khi chỉ định đặt máy phá rung cấy được. Những bệnh nhân nguy cơ cao đã đặt máy tạo nhịp hoặc xem xét lại chỉ định có thể điều trị tối ưu bằng tạo nhịp thất, đặt máy phá rung cấy được cho những bệnh nhân khởi kích được rối loạn nhịp thất kéo dài. Những tiến bộ không ngừng của máy khử rung cấy được về mặt kỹ thuật, mức độ tin cậy, giá thành, kích thước giúp tạo ra những ứng dụng rộng rãi cho bệnh nhân tim bẩm sinh.
Block nhĩ thất hoàn toàn hoặc tiến triển là một yếu tố nguy cơ đã được xác định gây nên đột tử và được giảm xuống do sử dụng máy tạo nhịp, tuy nhiên còn nhóm nhỏ bệnh nhân có nguy cơ do block xuất hiện muộn, hầu hết bệnh nhân có rối loạn dẫn truyền chu phẫu, nhưng các dữ kiện này không được thầy thuốc chú ý [39]. Bệnh nhân có hội chứng Down có nguy cơ xảy ra block nhĩ thất muộn [40]. Bất thường gen NKX 2.5 gây nên bệnh tim bẩm sinh, rối loạn dẫn truyền, bệnh cơ tim, đột tử [41]. Việc tầm soát bệnh lý này đối với bệnh nhân có thông liên nhĩ hoặc block nhĩ thất độ 1, độ 2 có thể cung cấp dữ kiện về nguy cơ, tuy nhiên việc chỉ định đặt máy khử rung cấy được cho nhóm bệnh này chưa được khuyến cáo.
Phòng ngừa loạn nhịp
Bệnh nhân có bệnh tim bẩm sinh có nguy rối loạn nhịp, việc điều trị những rối loạn nhịp này thường khó khăn và phức tạp. Những tổn thương về mặt giải phẫu ở tim đã được chứng minh là có nguy cơ gây loạn nhịp. Bệnh tim bẩm sinh thường gây nên các rối loạn nhịp trên thất (Bảng 15.2). Nhịp nhanh nhĩ có thể xuất hiện khi có các yếu tố nguy cơ ví dụ như tổn thương về mặt giải phẫu ở tâm nhĩ. Thí nghiệm trên chó cho thấy nhịp nhanh nhĩ có thể xuất hiện sau phẫu thuật có rạch tâm nhĩ [42]. Rối loạn chức năng nút xoang kết hợp với nhịp nhanh nhĩ có thể xảy ra sau phẫu thuật Fontan [43], máy tạo nhịp có thể làm giảm các triệu chứng do rối loạn nhịp. Ở bệnh nhân tứ chứng Fallot, một khi phức bộ QRS dài hơn 160ms được chứng minh là có liên quan đến nhịp nhanh nhĩ trong một nghiên cứu lớn trên những bệnh nhân được phẫu thuật lại [43]; thời gian sóng P dài ra có ý nghĩ tiên lượng loạn nhịp đã được ghi nhận [45]. Đường dẫn truyền phụ thường liên quan đến các bệnh lý van nhĩ thất, cần cân nhắc việc khảo sát điện sinh lý trước phẫu thuật nhằm xác định đường dẫn truyền phụ và cắt đốt.
Với những hiểu biết này, bước kế đến trong việc điều trị rối loạn nhịp đó là giảm thiểu nguy cơ xảy ra những rối loạn nhịp tiềm ẩn, hơn là điều trị những rối loạn nhịp đã xảy ra. Những vết sẹo phẫu thuật có thể mang nguy cơ rối loạn nhịp trong tương lai, trong phẫu thuật sửa chữa dị tật Tứ chứng Fallot cần nên tránh đường rạch – khâu ở vùng nút xoang và nút nhĩ thất, cũng tương tự như trong phẫu thuật sửa chữa dị tật Hoán vị Đại động mạch. Ngày nay, chúng ta đã có đầy đủ dữ kiện về tỉ lệ mới mắc và tử vong của những loạn nhịp muộn sau phẫu thuật tim, do vậy chúng ta cần sửa chữa dị tật sớm để phòng ngừa rối loạn nhịp và cắt đứt vòng xoắn bệnh lý gây loạn nhịp. Bảng 15.3 tổng hợp các bước tiếp cận của trung tâm chúng tôi xử trí rối loạn nhịp ở bệnh nhân có bệnh tim bẩm sinh. Chiến lược này bao gồm đánh giá tiền phẫu với chỉ định can thiệp: phẫu thuật loạn nhịp tim cùng lúc, đặt máy tạo nhịp sớm để tối ưu hóa nhịp tim, tái động bộ thất để cải thiện chức năng tâm thất, hoặc đặt máy phá rung cấy được. Khuyến cáo đặt máy tạo nhịp giúp phòng ngừa đột tử hoặc ngất, nhằm tối ưu hóa về nhịp tim và chức năng tim, cũng như ngăn ngừa những rối loạn nhịp.
Bảng 15.3: Phòng ngừa loạn nhịp
|
Biểu hiện |
Can thiệp |
|
Đường dẫn truyền phụ |
Khảo sát điện sinh lý trước phẫu thuật Cắt đốt đường phụ trước hoặc trong phẫu thuật |
|
Nhịp nhanh nhĩ do vào lại |
Giảm thiểu, thay đổi hoặc tránh rạch nhĩ Đánh giá trước phẫu thuật: kích cơn nhịp nhanh nhĩ, đặc biệt ở bệnh nhân phẫu thuật lại. Cắt đốt vòng vào lại bằng phẫu thuật Tránh nhịp chậm nhĩ, tạo nhịp sớm |
|
Nhịp nhanh do vòng vào lại nhĩ thất (AVRT) |
Nếu không xuất hiện, không cần điều trị dự phòng |
|
Rung nhĩ |
Phẫu thuật bệnh lý hở van nhĩ thất trước Phẫu thuật Maze đối với bệnh nhân cao tuổi, nguy cơ cao cần phẫu thuật thông liên nhĩ, hở van hai lá. Tránh thủ thuật cắt đốt kéo dài ở bệnh nhân có nhiều vòng vào lại tại nhĩ |
|
Nhịp nhanh thất |
Hạn chế đường rạch phẫu thuật tâm thất nếu có thể Can thiệp phẫu thuật sớm đối với hở van ĐM phổi /Tứ chứng Fallot Khảo sát điện sinh lý kích cơn nhịp nhanh thất, xét chỉ định cắt đốt điện sinh lý, phẫu thuật, hay đặt máy phá rung? Tạo nhịp 2 buồng thất hoặc nhiều vị trí để cải thiện chức năng đồng bộ tâm thất. |
|
Rung thất |
Máy phá rung cấy được ở bệnh nhân phân suất tống máu thấp, hoặc bệnh nhân được xác định bất thường gen NKX 2.5 Tạo nhịp 2 buồng thất hoặc nhiều vị trí để cải thiện chức năng đồng bộ tâm thất. |
|
Nhịp chậm xoang |
Cần đánh giá khả năng tạo nhịp để chẩn đoán nhịp Chậm đặt điện cực ngoại tâm mạc dự phòng Tạo nhịp |
|
Block nhĩ thất |
Theo dõi bệnh nhân để phát hiện: block nhĩ thất sau phẫu thuật, block 2 bó, block 3 bó Đặt điện cực ngoại tâm mạc dự phòng. |
Ca lâm sàng
Bệnh nhân với tắc nghẽn buồng tống thất phải, dự định sẽ phẫu thuật mở rộng buồng tống thất phải. Bệnh nhân được ghi nhận cơn nhịp nhanh liên quan gắng sức. Khảo sát điện sinh lý trong phẫu thuật bằng isoproterenol và khởi phát cơn nhịp nhanh thất 180 lần/phút với block nhánh trái, trục điện tim hướng xuống. Mapping ngoại tâm mạc và nội tâm mạc, tìm thấy sự hoạt hoá sớm nhất của nhịp nhanh xuất phát từ bề mặt của vách liên thất ở phía thất phải, bên trên miếng vá lỗ thông liên thất, cắt bỏ phần mô xơ sợi ở nội tâm mạc tại vách buồng nhận, cắt bỏ mô gây hẹp buồng tống thất phải và gia cố miếng vá ở phía buồng tống thất phải.
Theo dõi hậu phẫu, bệnh nhân không có rối loạn nhịp thất. Khảo sát điện sinh lý, có dùng adrenaline: âm tính. Test gắng sức 8 tuần sau đó, bệnh nhân có 1 ngoại tâm thu thất ở mức gắng sức tối đa và một cặp đôi ngoại tâm thu thất ở giai đoạn hồi phục. Đỉnh tiêu thụ oxygen 36ml/Kg/phút, với thời gian 13 phút. Theo dõi trong vòng 2 năm, bệnh nhân không có triệu chứng, không có ngoại tâm thu thất khi theo dõi bằng Holter ECG.
Tài liệu tham khảo:
- Polderman FN, Cohen J, Blom NA, et al. Sudden unexpected death in children with a previously diagnosed cardiovascular disorder. Int J Cardiol 2004;95:171–6.
- van der Velde ET, Vriend JW, Mannens MM, et al. CONCOR, an initiative towards a national registry and DNA-bank of patients with congenital heart disease in the Netherlands: rationale, design, and first results. Eur J Epidemiol 2005;20:549–57.
- Gatzoulis MA, Till JA, Somerville J, Redington AN. Mechanoelectrical interaction in tetralogy of Fallot. QRS prolongation relates to right ventricular size and predicts malignant ventricular arrhythmias and sudden death. Circulation 1995;92:231–7.
- Gatzoulis MA, Balaji S, Webber SA, et al. Risk factors for arrhythmia and sudden cardiac death late after repair of tetralogy of Fallot: a multicentre study. Lancet 2000;356:975–81.
- Chandar JS, Wolff GS, Garson A Jr, et al. Ventricular arrhythmias in postoperative tetralogy of Fallot. Am J Cardiol 1990;65:655–61.
- Garson A Jr, Randall DC, Gillette PC, et al. Prevention of sudden death after repair of tetralogy of Fallot: treatment of ventricular arrhythmias. J Am Coll Cardiol 1985;6: 221–7.
- Trappe HJ, Brandts B, Weismueller P. Arrhythmias in the intensive care patient. Curr Opin Crit Care 2003;9:345–55.
- Deal BJ. Management of arrhythmias in patients with repaired congenital heart disease. In: Griffiths M, ed. Management of Cardiovascular Conditions of Adults in Acute Care. London: Blackwell Publishing, 2008.
- Naccarelli GV, Wolbrette DL, Khan M, et al. Old and new antiarrhythmic drugs for converting and maintaining sinus rhythm in atrial fibrillation: comparative efficacy and results of trials. Am J Cardiol 2003;91:15D–26D.
- Thorne SA, Barnes I, Cullinan P, Somerville J. Amiodarone-associated thyroid dysfunction: risk factors in adults with congenital heart disease. Circulation 1999;100: 149–54.
- Walsh EP. Interventional electrophysiology in patients with congenital heart disease. Circulation 2007;115:3224–34.
- Collins KK, Love BA, Walsh EP, et al. Location of acutely successful radiofrequency catheter ablation of intraatrial reentrant tachycardia in patients with congenital heart disease. Am J Cardiol 2000;86:969–74.
- Kannankeril PJ, Anderson ME, Rottman JN, et al. Frequency of late recurrence of intra-atrial reentry tachycardia after radiofrequency catheter ablation in patients with congenital heart disease. Am J Cardiol 2003;92:879–81.
- Triedman JK, Alexander ME, Berul CI, et al. Electroanatomic mapping of entrained and exit zones in patients with repaired congenital heart disease and intra-atrial reentrant tachycardia. Circulation 2001;103:2060–5.
- Triedman JK, Bergau DM, Saul JP, et al. Efficacy of radiofrequency ablation for control of intraatrial reentrant tachycardia in patients with congenital heart disease. J Am Coll Cardiol 1997;30:1032–8.hapter 15 Arrhythmias in congenital heart disease 235
- Silka MJ, Manwill JR, Kron J, McAnulty JH. Bradycardia-mediated tachyarrhythmias in congenital heart disease and responses to chronic pacing at physiologic rates. Am J Cardiol 1990;65:488–93.
- Deal BJ, Mavroudis C, Backer CL. Beyond Fontan conversion: Surgical therapy of arrhythmias including patients with associated complex congenital heart disease. Ann Thorac Surg 2003;76:542–53, discussion 553–4.
- Mavroudis C, Deal BJ, Backer CL, et al. J. Maxwell Chamberlain Memorial Paper for congenital heart surgery. 111 Fontan conversions with arrhythmia surgery: surgical lessons and outcomes. Ann Thorac Surg 2007;84:1457–65.
- Morales DL, Dibardino DJ, Braud BE, et al. Salvaging the failing Fontan: lateral tunnel versus extracardiac conduit. Ann Thorac Surg 2005;80:1445–51.
- Weinstein S, Chan D. Extracardiac Fontan conversion, cryoablation, and pacemaker placement for patients with a failed Fontan. Semin Thorac Cardiovasc Surg 2005;17: 170–8.
- Sheikh AM, Tang AT, Roman K, et al. The failing Fontan circulation: successful conversion of atriopulmonary connections. J Thorac Cardiovasc Surg 2004;128:60–6.
- Deal BJ, Mavroudis C, Backer CL, et al. Comparison of anatomic isthmus block with the modified right atrial maze procedure for late atrial tachycardia in Fontan patients. Circulation 2002;106:575–9.
- Morwood JG, Triedman JK, Berul CI, et al. Radiofrequency catheter ablation of ventricular tachycardia in children and young adults with congenital heart disease. Heart Rhythm 2004;1:301–8.
- HarrisonDA, Harris L, Siu SC, et al. Sustained ventricular tachycardia in adult patients late after repair of tetralogy of Fallot. J Am Coll Cardiol 1997;30:1368–73.
- Deal BJ, Mavroudis C, Backer CL. Beyond Fontan conversion: Surgical therapy of arrhythmias including patients with associated complex congenital heart disease. Ann Thorac Surg 2003;76:542–53.
- Silka MJ, Hardy BG, Menashe VD, Morris CD. A population-based prospective evaluation of risk of sudden cardiac death after operation for common congenital heart defects. J Am Coll Cardiol 1998;32:245–51.
- Basso C, Frescura C, Corrado D, et al. Congenital heart disease and sudden death in the young. Hum Pathol 1995;26:1065–72.
- Oechslin EN, Harrison DA, Connelly MS, et al. Mode of death in adults with congenital heart disease. Am J Cardiol 2000;86:1111–6.
- Nieminen HP, Jokinen EV, Sairanen HI. Causes of late deaths after pediatric cardiac surgery: a population-based study. J Am Coll Cardiol 2007;50:1263–71.
- Autore C, Quarta G, Spirito P. Risk stratification and prevention of sudden death in hypertrophic cardiomyopathy. Curr Treat Options Cardiovasc Med 2007;9:431–5.
- Elliott PM, Gimeno JR, Tom´e MT, et al. Left ventricular outflow tract obstruction and sudden death risk in patients with hypertrophic cardiomyopathy. Eur Heart J 2006;27:1933–41.
- Spirito P, Bellone P, Harris KM, et al. Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. N Engl J Med 2000;342:1778– 85.
- Therrien J, Siu SC, Harris L, et al. Impact of pulmonary valve replacement on arrhythmia propensity late after repair of tetralogy of Fallot. Circulation 2001;103: 2489-94ease
- Gatzoulis MA, Till JA, Redington AN. Depolarization-repolarization inhomogeneity after repair of tetralogy of Fallot. The substrate for malignant ventricular tachycardia? Circulation 1997;95:401–4.
- Tateno S, Niwa K, Nakazawa M, et al. Risk factors for arrhythmia and late death in patients with right ventricle to pulmonary artery conduit repair–Japanese multicenter study. Int J Cardiol 2006;106:373–81.
- Lammers A, Kaemmerer H, Hollweck R, et al. Impaired cardiac autonomic nervous activity predicts sudden cardiac death in patients with operated and unoperated congenital cardiac disease. J Thorac Cardiovasc Surg 2006;132:647–55
- Sun ZH, Happonen JM, Bennhagen R, et al. Increased QT dispersion and loss of sinus rhythm as risk factors for late sudden death after Mustard or Senning procedures for transposition of the great arteries. Am J Cardiol 2004;94:138–41.
- Khairy P, Landzberg MJ, Gatzoulis MA, et al. Value of programmed ventricular stimulation after tetralogy of fallot repair: a multicenter study. Circulation 2004;109:1994– 2000.
- Krongrad E. Prognosis for patients with congenital heart disease and postoperative intraventricular conduction defects. Circulation 1978;57:867–70.
- Banks MA, Jenson J, Kugler JD. Late development of atrioventricular block after congenital heart surgery in Down syndrome. Am J Cardiol 2001;88:A7, 86–9.
- Benson DW. Genetics of atrioventricular conduction disease in humans. Anat Rec A Discov Mol Cell Evol Biol 2004;280:934–9.
- Rodefeld MD, Bromberg BI, Schuessler RB, et al. Atrial flutter after lateral tunnel construction in the modified Fontan operation: a canine model. J Thorac Cardiovasc Surg 1996;111:514–26.
- Fishberger SB,Wernovsky G, Gentles TL, et al. Factors that influence the development of atrial flutter after the Fontan operation. J Thorac Cardiovasc Surg 1997;113:80–6.
- Karamlou T, Silber I, Lao R, et al. Outcomes after late reoperation in patients with repaired tetralogy of Fallot: the impact of arrhythmia and arrhythmia surgery. Ann Thorac Surg 2006;81:1786–93.
- Koh M, Yagihara T, Uemura H, et al. Optimal timing of the Fontan conversion: change in the P-wave characteristics precedes the onset of atrial tachyarrhythmias in patients with atriopulmonary connection. J Thorac Cardiovasc Surg 2007;133:1295–302.

Để lại bình luận
Bạn cần phải đăng nhập để đăng bình luận.