Michael A.Gatzoulis and Lorna Swan
Người dịch: BS Từ Ngọc Thủy Hiền
Bệnh nhân nam 22 tuổi này bị suy tim chỉ một thời gian ngắn sau khi sinh. Kiểm tra phát hiện bệnh nhân bị không lỗ van 3 lá với chuyển vị đại động mạch và thông liên nhĩ. Các triệu chứng không cải thiện với các thuốc lợi tiểu, và lúc 1 tuổi, bệnh nhân được phẫu thuật siết động mạch phổi. Lúc 7 tuổi, làm thông tim can thiệp ghi nhận áp lực động mạch phổi thấp( áp lực động mạch phổi trung bình là 11mmHg); bệnh nhân được làm phẫu thuật Kreutzer Fontan nối trực tiếp tiểu nhĩ phải vào động mạch phổi.
Lúc 20 tuổi, bệnh nhân bị nhịp nhanh nhĩ kịch phát và được khởi đầu điều trị Amiodarone thêm vào với Enalapril và Coumadin.
Lúc 22 tuổi, bệnh nhân có triệu chứng suy tim cấp độ III theo NYHA. Khám lâm sàng ghi nhận có ngón tay dùi trống và độ bão hòa Oxy lúc nghỉ 93%. Nhịp tim không đều 90 lần/ phút. Huyết áp lúc nghỉ = 96/60mmHg. Áp lực tĩnh mạch cổ > 6cm và phù nhẹ mắt cá. Phổi trong.
Điện tâm đồ có rung nhĩ và siêu âm tim cấp cứu ghi nhận nhĩ phải dãn lớn và có cục máu đông lớn trong nhĩ phải. Ngoài ra còn có chèn ép ở các tĩnh mạch phổi phải và giảm nhẹ chức năng thất trái.
Xét nghiệm máu xác định có cường giáp do Amiodarone, nên bệnh nhân cần được điều trị kéo dài với kháng viêm Steroids, Carbimazole và Lithium trước khi ổn.
Mở đầu :
Thuật ngữ “ tâm thất độc nhất sinh lý “ bao gồm một nhóm hỗn hợp vài bệnh trong số các bệnh tim bẩm sinh phức tạp nhất. Có nhiều định nghĩa theo giải phẫu học [1,2], nhưng trong thực hành ở người lớn, thuật ngữ này thường dùng để mô tả một vòng tuần hoàn với một trong hai thất quá nhỏ, hoặc có một van nhận không thể sửa chữa được, để cho phép thực hiện hiệu quả chức năng tuần hoàn. Đây cũng bao gồm những bệnh lúc nhỏ tưởng như không phù hợp để sửa chữa hai thất.
Vì vậy định nghĩa rộng bệnh gọi là tâm thất độc nhất bao gồm hội chứng thiểu sản thất trái, không lỗ van hay thiểu sản các van nhĩ thất, kênh nhĩ thất không cân xứng, vài hội chứng bất thường vị trí, và tâm thất hai đường nhận. Nhóm này cũng bao gồm bệnh thất phải hai đường ra phức tạp với thông liên thất phần xa khó sửa chữa thành hai thất.
Vài mô tả khác thì ghi nhận toàn bộ chỗ nối nhĩ thất chỉ nối với một buồng thất. Tuy nhiên, đây là định nghĩa hẹp hơn, không bao gồm nhóm sau và vài bệnh thiểu sản thất trái.
Tần suất:
Có sự khác nhau quan trọng giữa tần suất và sự lưu hành bệnh tâm thất độc nhất trong thực hành người lớn hiện tại so với trẻ con. Trước đây, nhiều trẻ bệnh này tử vong lúc nhỏ, và những bệnh nhân hiện tại trong nhóm người lớn chứng minh cho thực hành phẫu thuật ở trẻ con từ 15- 20 năm trước. Sự lưu hành bệnh này trong thực hành tim bẩm sinh người lớn rất thay đổi. Những nhóm bệnh nhân cũ với phẫu thuật “ kiểu cũ”( như là phẫu thuật Kreutzer Fontan với nối trực tiếp nhĩ phải vào động mạch phổi) đang giảm dần, và ngược lại, số lượng các bệnh nhân mới với hội chứng thiểu sản thất trái được sửa chữa tạm thời đang tăng dần [3]. Nhìn chung, số bệnh nhân bị tâm thất độc nhất phức tạp đang tăng dần [4].
Khó xác định được bệnh sử tự nhiên thực sự của các bệnh này, nhưng < 30 % các bệnh nhân với tâm thất độc nhất thất trái ưu thế không cần can thiệp vẫn sống được qua thời thơ ấu [5]. Bệnh nhân tâm thất độc nhất với thất phải ưu thế có tỷ lệ này thấp hơn. Dạng tâm thất độc nhất thường gặp nhất khi sinh là thiểu sản thất trái, không lỗ van 3 lá, thất trái 2 đường nhận [6].
Nguyên nhân:
Cũng giống như phần lớn các trường hợp bệnh tim bẩm sinh, đây là bệnh phức tạp không di truyền nhưng có tính gia đình. Đây là bệnh lý có nguyên nhân đa yếu tố. Ví dụ như, có sự gia tăng nguy cơ mắc các bệnh bẩm sinh khác ở anh chị em ruột của trẻ bị thiểu sản thất trái [7]. Mức độ lập lại có tính gia đình này khác nhau với những tổn thương khác nhau và cao hơn ở một số phân nhóm xác định, như đồng dạng nhĩ [8,9]. Thỉnh thoảng cũng có những trường hợp bệnh tâm thất độc nhất phức tạp có tính di truyền trong gia đình, ví dụ như, bất thường vị trí có tính gia đình [9] và những trường hợp không lỗ van 3 lá đơn độc kết hợp với những khiếm khuyết nhiễm sắc thể ( như 22q11)[10]. Tuy nhiên , trong phần lớn các trường hợp, không thể xác định được bất thường nhiễm sắc thể hoặc đột biến gen. Trong tương lai, các nghiên cứu trên chuột bị bệnh tim bẩm sinh có thể giúp xác định được một số đột biến là nguyên nhân chuyên biệt trên người.
Các thành phần chính về hình thái học:
Tiếp cận một cách hệ thống để mô tả những tổn thương phức tạp này là thiết yếu [11]. Mô tả sự sắp xếp nhĩ, sự nối liền nhĩ- thất, hình dạng tâm thất và sự nối liền tâm thất – đại động mạch là thành phần chủ yếu. Mô tả sự trở về của tĩnh mạch phổi và tĩnh mạch hệ thống cùng với những tổn thương đi kèm cũng cần để giúp có một chẩn đóan đầy đủ. ( Bảng 11.1)
Bảng 11.1: Những thành phần lâm sàng chính về hình thái học

Hình dạng tâm thất:
Một tâm thất bình thường có 3 phần: phần nhận, phần thoát và phần cơ bè. Vùng cơ bè ở mỏm là đặc trưng nhất. Cơ bè thất trái thì mịn, còn cơ bè thất phải thì thô, trừ trường hợp cả hai thất đều không trội cho thất nào ( không là phải hoặc trái ). Hiếm khi có một tâm thất độc nhất thực sự. nhưng không không xác định được dạng thất phải hay thất trái. Một số đặc điểm khác của tâm thất thường được bỏ qua trong tâm thất độc nhất, ví dụ như, dây chằng bám vách bình thường của van ba lá, vị trí gần mỏm của van ba lá, hoặc sự liên tục mô sợi giữa van hai lá và van động mạch chủ. Hai thuật ngữ khác dùng để mô tả mối liên hệ giữa các thất. Thuật ngữ “ topology” ( hình học) dùng để mô tả mối liên hệ khuôn mẫu giữa hai thất (bình thường trong tim hai buồng thất là dạng bàn tay phải), và thuật ngữ “looping” ( xoay vòng) thì thiên về sự uốn lượn của tim trong thời kỳ phôi thai. Trong d-looping, thất có dạng thất phải thì nằm bên phải của thất trái( bình thường ); trong l-looping thì nằm về phía bên trái.
Lúc đầu, các thành phần chính về hình thái học sẽ ảnh hưởng đến sự đầy đủ của tuần hoàn phổi và tuần hoàn hệ thống. Ở bệnh nhân bị thiểu sản thất trái, tình trạng giảm cung lượng tim xảy ra sau khi đóng ống động mạch. Sự hiện diện hoặc bất lợi của một tuần hoàn phổi hiệu quả sẽ biểu hiện sớm. Tím biểu hiện khi có hẹp phổi nặng hoặc không có van động mạch phổi
Biểu hiện ban đầu lúc nhỏ:
Trẻ bị tâm thất độc nhất thường biểu hiện sớm trong cuộc đời. Trẻ có tuần hoàn phổi không được bảo vệ thường biểu hiện do ảnh hưởng huyết động học của luồng thông lớn từ trái sang phải, đó là suy tim sung huyết và suy tim nặng. Trẻ có lưu lượng máu lên phổi hạn chế nặng có biểu hiện tím sau khi đóng ống động mạch. Trẻ sơ sinh có tắc nghẽn thất trái nặng sẽ biểu hiện sớm sự suy sụp tuần hoàn hoặc giảm tưới máu các cơ quan sinh tồn
Đôi khi, một đứa trẻ có thể có một tuần hoàn cân bằng khi có hẹp phổi ở mức độ đủ để ngăn chặn suy tim nhưng không quá nhiều để gây tím. Trong trường hợp này, biểu hiện lâm sàng có thể trễ hơn, đặc biệt là khi không thể tầm soát thường qui ở trẻ sơ sinh [12].
Phẫu thuật tạm thời ban đầu:
Phần lớn các trẻ sơ sinh đều cần phẫu thuật tạm thời ban đầu, dựa vào giải phẫu và sinh lý học căn bản. Nếu không can thiệp phẫu thuật, những trẻ bị bệnh nặng ( như thiểu sản thất trái) thường sẽ tử vong trong vài ngày. Chỉ trong vòng một thập kỷ qua, sự can thiệp lên kết cục tử vong của tâm thất độc nhất thể nặng nhất đã trở nên thường qui [13].
Phẫu thuật siết bớt động mạch phổi:
Khi tuần hoàn phổi không được bảo vệ ( không có hẹp phổi), có một luồng thông lớn từ trái sang phải. Luồng thông này gây suy tim sung huyết, và sau đó gây bệnh mạch máu phổi nếu trẻ còn sống. Trong trường hợp này, phẫu thuật đầu tiên có thể là xiết bớt động mạch phổi để làm giảm có kiểm sóat lưu lượng máu lên phổi. Nếu vòng xiết quá lỏng, lưu lượng máu lên phổi vẫn nhiều làm cho trẻ dễ có nguy cơ bị bệnh mạch máu phổi và trở nên không thích hợp cho những điều trị sâu hơn. Vòng xiết động mạch phổi cần phải được đặt cẩn thận: không quá xa để tránh hẹp lổ xuất phát các nhánh động mạch phổi, và không quá gần, đặc biệt là nếu trẻ sau này cần làm phẫu thuật Damus- Kaye Stansel( nối phần gần động mạch phổi vào động mạch chủ lên để vượt qua chỗ tắc nghẽn đường ra thất trái ).
Phẫu thuật tạo thông nối động mạch chủ động mạch phổi:
Khi có hẹp phổi nặng ( hẹp dưới van, tại van hoặc trên van), lưu lượng máu lên phổi không đủ. Phẫu thuật tạm thời tạo luồng thông nối động mạch chủ động mạch phổi cần để giúp cho trẻ phát triển và để kháng lực mạch máu phổi giảm dần đến khi phẫu thuật triệt để hơn có thể thực hiện. Phẫu thuật thông nối động mạch chủ động phổi đầu tiên là phẫu thuật Blalock- Taussig cổ điển với khâu nối động mạch dưới đòn với động mạch phổi cùng bên( mô tả đầu tiên vào 1945) [14]. Sau đó là sự ra đời của một số phẫu thuật cải tiến như phẫu thuật Waterston (nối động mạch chủ lên với động mạch phổi phải), phẫu thuật Pott’s (nối động mạch chủ xuống với động mạch phổi trái), và sau cùng là phẫu thuật Blalock- Taussig cải tiến sử dụng ống Gortex nhân tạo nhỏ tạo luồng thông. Bệnh nhân người lớn với tâm thất độc nhất đã từng trải qua nhiều loại phẫu thuật tạm thời ban đầu trước khi có sự ra đời hiệu quả của phẫu thuật Blalock- Taussig cải tiến.
Phẫu thuật tạo luồng thông động mạch chủ động mạch phổi cũng được thực hiện trong thiểu sản thất trái, dùng thân động mạch phổi tạo tuần hoàn hệ thống( phẫu thuật Norwood). Vì vậy, phẫu thuật tạo luồng thông động mạch chủ động mạch phổi thì cần thiết để đảm bảo lưu lượng máu lên phổi.
Một số phẫu thuật khác cũng cần trong giai đoạn sớm. Đặc biệt là nếu có tổn thương tắc nghẽn như thông liên thất hạn chế ( trong trường hợp bất tương hợp thất đại động mạch) hoặc tắc nghẽn cung động mạch chủ ( hẹp eo động mạch chủ). Phẫu thuật cắt bỏ vách liên nhĩ thường dùng trong trường hợp các van nhĩ thất bất thường, hẹp hoặc không có van nhĩ thất.
Phẫu thuật tạo luồng thông tĩnh mạch chủ động mạch phổi:
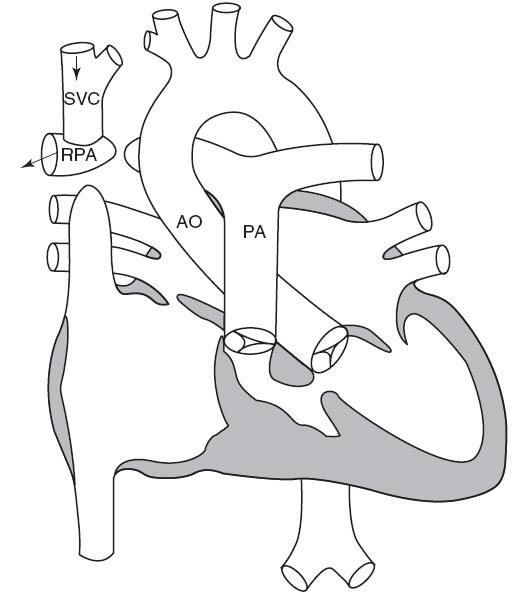
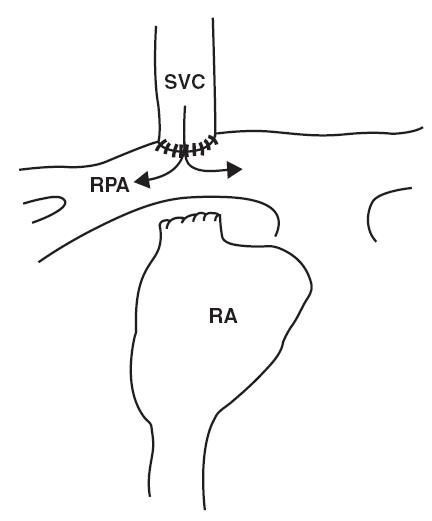
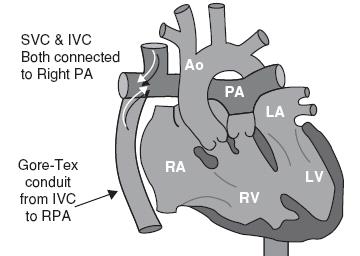
Năm 1957, Glenn lần đầu tiên mô tả phẫu thuật tạo luồng thông tĩnh mạch chủ động mạch phổi. Phẫu thuật này liên quan đến sự phân chia các nhánh động mạch phổi và chỗ nối đầu tận của tĩnh mạch chủ trên với động mạch phổi phải [15]. Trong sự phát triển của phẫu thuật tạo luồng thông tĩnh mạch chủ động mạch phổi, phẫu thuật Glenn cổ điển là phẫu thuật đầu tiên và phẫu thuật tạo thông nối tĩnh mạch chủ động mạch phổi tòan phần, phẫu thuật Fontan ngoài tim là những phẫu thuật sau cùng.( Hình 11.1)
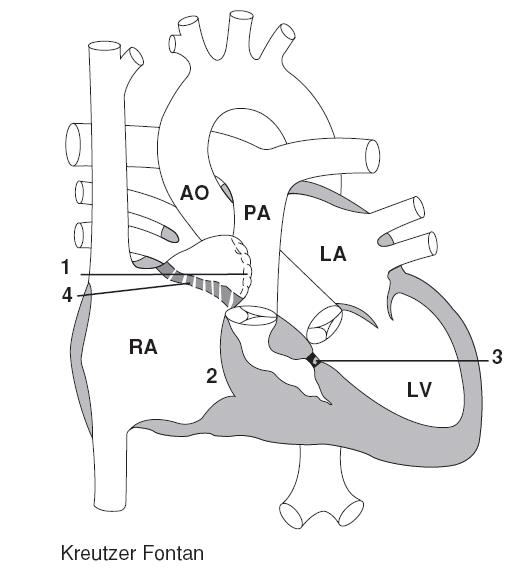
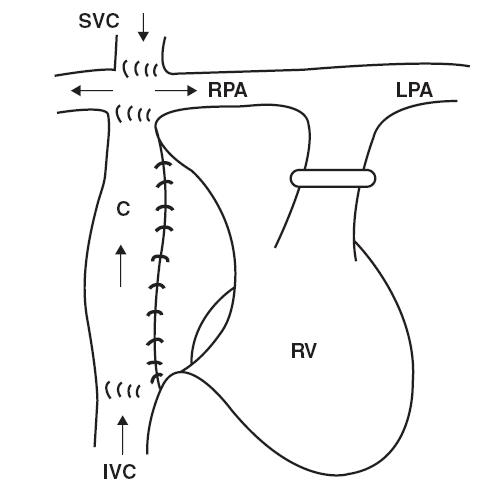
Năm 1971, Fontan mô tả một phẫu thuật, sau phẫu thuật Glenn cổ điển, đặt hai van ghép đồng thân : một ở tĩnh mạch chủ dưới và một ở giữa nhĩ phải và động mạch phổi trái [16]. Từ đó , đã có nhiều phẫu thuật Fontan cải tiến có thể thấy được ở những bệnh nhân người lớn còn sống. Phẫu thuật tạo thông nối tĩnh mạch chủ động mạch phổi toàn phần được mô tả đầu tiên vào năm 1987, và do đó, những bệnh nhân trẻ và thiếu niên được làm phẫu thuật cải tiến nhất này bây giờ là những bệnh nhân trong thực hành lâm sàng ở người lớn [17].
Qua thăm khám , các bệnh nhân được đánh giá là có thể thực hiện được phẫu thuật tạo thông nối tĩnh mạch chủ động mạch phổi nếu như thỏa mãn “ muời điều răn” cho phẫu thuật Fontan. Các yêu cầu bao gồm tuổi từ 4-15; tĩnh mạch hệ thống trở về bình thường; áp lực động mạch phổi trung bình ≤ 15mmHg; chức năng tâm thất tốt; các van nhĩ thất bảo tồn; và động mạch phổi không bị vặn vẹo[18].
Phẫu thuật Glenn cổ điển
Hình 11.1: Thông nối tĩnh mạch chủ – động mạch phổi. SVC: tĩnh mạch chủ trên; RPA: động mạch phổi phải; AO: động mạch chủ; PA: động mạch phổi; RA: nhĩ phải; LA: nhĩ trái; LV : thất trái; LPA: động mạch phổi trái; RV: thất phải; IVC: tĩnh mạch chủ dưới; TCPC: nối tĩnh mạch chủ động mạch phổi toàn phần
Phẫu thuật Glenn hai chiều
Đường hầm bên (Lateral tunnel )
Thất phải hai đường ra
Phẫu thuật Fontan ngoài tim (TCPC)
Nhiều bệnh nhân người lớn có thể đã được phẫu thuật theo từng giai đoạn lúc nhỏ. Phẫu thuật Glenn có thể khởi đầu trợ giúp cho tuần hoàn của trẻ. Tuy nhiên, theo thời gian, lưu lượng tĩnh mạch chủ trên đổ về theo hồi lưu tĩnh mạch toàn phần giảm đi và tím tăng dần thì cần làm phẫu thuật Fontan toàn phần để phục hồi độ bão hòa Oxy.
Những phẫu thuật tạm thời tạo luồng thông tĩnh mạch chủ động mạch phổi, bao gồm phẫu thuật Fontan, đã giúp cho những bệnh nhân tâm thất độc nhất có kết quả từ ngắn hạn sang trung hạn và trả lại cho họ sự hồng hào. Mặc dù những kết quả trung hạn tuyệt vời đã được tuờng thuật( > 90 % sống được 10 năm), cũng còn một số vấn đề liên quan đến nhiều biến chứng, và khả năng sống còn lâu dài thì còn phải xem xét. Chính vì vậy mà điều quan trọng là phải hiểu rằng những phẫu thuật này chỉ mang tính tạm thời hơn là sửa chữa hòan tòan.
Các thể bệnh có tuần hoàn kiểu tâm thất độc nhất:
- Thiểu sản thất trái:
Hiện chỉ có một số ít bệnh nhân người lớn bị hội chứng thiểu sản thất trái còn sống, dù đây là dạng thường gặp nhất của tâm thất độc nhất sinh lý. Tuy nhiên, với những tiến bộ trong điều trị, con số này sẽ thay đổi, và nhiều đơn vị bệnh tim bẩm sinh ở người lớn hy vọng sẽ gặp những bệnh nhân này trong vài năm tới. Các bệnh nhân người lớn thường đã được làm phẫu thuật tạm thời như phẫu thuật Norwood, phẫu thuật Fontan bán phần( phẫu thuật Glenn hai chiều), và phẫu thuật Fontan sửa chữa tòan phần. Trong phẫu thuật Norwood, động mạch phổi được khâu nối vào động mạch chủ đọan gần . Động mạch chủ vì vậy mà được đẩy mạnh lên và một luồng thông kiểu Blalock Tausisg cải tiến đựơc tạo ra để đảm bảo tuần hoàn phổi. Trong thực hành lâm sàng hiện tại, gần 85% trẻ có giải phẫu thuận lợi sẽ sống qua giai đọan đầu của phẫu thuật Norwood [19].
- Tâm thất hai đường vào:
Gọi là tâm thất hai đường vào khi có > 50% cả hai nhĩ nối với một tâm thất chính độc nhất. Thông thường thì nối qua hai van nhĩ thất riêng biệt , nhưng cũng có thể nối qua van nhĩ thất chung. Các van nhĩ thất có thể bất thường như thiểu sản, loạn sản hay bất sản . Một số bất thường khác kèm theo thường là bất tương hợp thất- đại động mạch ( thường gặp), hẹp động mạch phổi( hẹp dưới van hoặc tại van), vách liên thất lệch hàng, thông liên thất hạn chế và hẹp eo động mạch chủ.
Ngoài các phẫu thuật được mô tả ở trên, những bệnh nhân này cần được mở rộng lỗ thông liên thất hạn chế, là nguyên nhân gây tắc nghẽn dưới động mạch chủ. Khi phẫu thuật, cần phải xem xét giải phẫu của mô dẫn truyền. Nếu thất trái ưu thế, nút nhĩ thất và bó His ở phía trước và bên phải. Nếu có tắc nghẽn nặng dưới động mạch chủ, có thể làm phẫu thuật Damus- Kaye- Stansel.
Tắc nghẽn dưới động mạch chủ là một yếu tố nguy cơ cho phẫu thuật Fontan sau này do tâm thất phì đại quá mức và rối loạn chức năng tâm trương [20]. Ở trẻ nhỏ, một số có thất trái hai đường vào “ lý tưởng” có thể điều trị giữ hai tâm thất. Ở người lớn thì cực kỳ hiếm do một số tổn thương phát sinh, như bệnh mạch máu phổi.
Bệnh nhân với tâm thất trái hai đường vào ( dạng xoay vòng trái ) thì có nguy cơ block tim hoàn toàn, và cũng như các tổn thương phức tạp nhất, có nguy cơ đột tử do rối loạn nhịp [21].
- Không lỗ van nhĩ thất:
Không có một trong hai van nhĩ thất là một dạng khác của tâm thất độc nhất. Trong trường hợp này, van còn lại sẽ nối với buồng thất chính. Van nhĩ thất thường khiếm khuyết hoàn toàn và tại chỗ nối nhĩ thất là mô sợi – mỡ. Các van nhĩ thất có thể giảm sản hoặc không có lỗ van; trong trường hợp này vẫn còn sự kết nối nhĩ với hai buồng thất ( chỉ về mặt giải phẫu, không có chức năng).
Dạng thường gặp nhất trong không lỗ van nhĩ thất là không lỗ van ba lá [22]. Trong trường hợp này, vẫn còn một thất phải nhỏ từ phôi thai ở phía trước trên. Trong 30% trường hợp, buồng thất phải ở dưới động mạch chủ ( bất tương hợp thất- đại động mạch). Không lỗ van ba lá dạng kinh điển thì có tương hợp thất- đại động mạch. Khi đó , lỗ thông liên nhĩ hạn chế sẽ gây cản trở sự trở về của tĩnh mạch hệ thống vì đây là con đường duy nhất để máu qua van hai lá và buồng thất.
Không lỗ van hai lá thường ít gặp trong thực hành người lớn. Tổn thương thường đi kèm với thất phải ưu thế hai đường ra. Trong một số ít trường hợp, không lỗ van hai lá là một phần của hội chứng thiểu sản thất trái
Nguyên tắc phẫu thuật tạm thời bệnh nhân không có thông thương nhĩ thất đã được mô tả như trên, là bảo đảm đủ lượng máu lên phổi và hệ thống và ngăn chặn bệnh lý mạch máu phổi. Trong trường hợp kháng lực mạch máu phổi lý tưởng, có thể khởi đầu làm phẫu thuật Glenn hai chiều.
Trong thực hành người lớn, đa số các bệnh nhân người lớn không lỗ van ba lá thường đã được làm phẫu thuật Fontan trước đó( thường là phẫu thuật Kreutzer cải tiến). Thỉnh thoảng cũng có những bệnh nhân với tuần hoàn cân bằng có thể sống đến lớn mà không cần phẫu thuật.
Cần phải đánh giá lại những bệnh nhân đã được phẫu thuật tạm thời trước đây, như phẫu thuật Blalock Taussig hoặc phẫu thuật siết động mạch phổi. Những bệnh nhân có kháng lực mạch máu phổi thấp ( áp lực động mạch phổi trung bình < 15mmHg) có thể làm phẫu thuật Fontan muộn. Tuy nhiên , việc này cũng không thường lắm vì phần lớn các bệnh nhân đều chuyển dạng và suy yếu dần. Phẫu thuật Fontan muộn trong trường hợp này, ngay cả khi giải phẫu lý tưởng, vẫn có tỷ lệ tử vong chu phẫu quan trọng kèm theo [23].
- Các hội chứng bất thường vị trí:
Thuật ngữ bất thường vị trí dùng để mô tả các rối loạn về sự sắp xếp các tạng và mạch máu trong lồng ngực và trong ổ bụng. Đồng dạng ( “ các phần như nhau”) mô tả sự nhân đôi của một cấu trúc, như nhĩ trái, nhĩ phải , phế quản hoặc phổi. Thuật ngữ “ situs solitus” mô tả sắp xếp nhĩ bình thường( nhĩ phải ở bên phải và nhĩ trái ở bên trái); thuật ngữ “ situs inversus” là sắp xếp ngược lại. Một nhóm bệnh nhân này có giải phẫu phức tạp với sinh lý kiểu tâm thất độc nhất. Các bất thường đi kèm với đồng dạng nhĩ trái và phải được mô tả trong bảng 11.2
Bảng 11.2 : Một số bất thường cùng với đồng dạng nhĩ:
|
|
Đồng dạng nhĩ trái |
Đồng dạng nhĩ phải |
|
Tâm nhĩ |
Tiểu nhĩ hình ngón tay Mặt nhẵn Không có nút xoang |
Tiểu nhĩ hình tam giác Mào tận cùng Cơ hình lược Hai nút xoang |
|
Nối liền tĩnh mạch |
Không có tĩnh mạch chủ dưới Nối liền tĩnh mạch đơn ( Azygous) Tĩnh mạch chủ trên hai bên Tĩnh mạch chủ trên phải nhỏ hoặc không có Xoang vành bất thường Kênh nhĩ thất ( 30%) Thất phải hai đường ra( 40%) Hoán vị đại động mạch ( 20%) Hẹp động mạch phổi( 40%) Hẹp dưới van động mạch chủ |
Tĩnh mạch chủ trên hai bên Nối liền bất thường tĩnh mạch phổi toàn phần ( thường là thể trên tim) Xoang vành bất thường Thông liên nhĩ lớn Van nhĩ thất chung ( 71%) Thất phải hai đường ra với hoán vị đại động mạch( 80%) Tắc nghẽn đường thoát thất phải ( 90%) |
|
Ổ bụng
|
Đa lách Bất sản mật Bất thường vị trí các tạng |
Không có lách Bất thường vị trí các tạng |
Mặc dù tỷ lệ đồng dạng nhĩ phải lúc sinh cao, chỉ một số ít bệnh nhân sống đến tuổi trưởng thành [24]. Ngay cả khi những kỹ thuật phẫu thuật đang cải tiến thì biến chứng tắc nghẽn tĩnh mạch phổi phức tạp và khả năng nhiễm trùng ( do giảm chức năng lách) xảy ra <30% bệnh nhân đến tuổi trưởng thành; ở bệnh nhân đồng dạng nhĩ phải thì khoảng 45 %[25].
Bảng 11.3 :Các vấn đề có thể gặp ở người lớn bị tâm thất độc nhất
|
Không có phẫu thuật trước đây Tuần hoàn “cân bằng” với hẹp động mạch phổi Tăng áp động mạch phổi Phẫu thuật tạm thời Siết động mạch phổi để tạo “tuần hòan cân bằng” Siết động mạch phổi không đủ dẫn đến bệnh mạch máu phổi Phẫu thuật tạo luồng thông chủ phổi Phẫu thuật Blalock- Taussig Phẫu thuật Waterston Phẫu thuật Pott Phẫu thuật tạo thông tĩnh mạch Phẫu thuật Glenn kinh điển Phẫu thuật Glenn hai chiều Phẫu thuật Fontan ( nhiều cải tiến bao gồm phẫu thuật nối tĩnh mạch chủ động mạch phổi toàn phần) Những phẫu thuật khác Mở rộng thông liên thất Cắt bỏ vách liên nhĩ Sửa chữa hẹp eo động mạch chủ Tạo hình van nhĩ thất Phẫu thuật Norwood trong thiểu sản thất trái |
|
|
Biểu hiện lâm sàng ở người lớn:
Bệnh nhân người lớn bị tâm thất độc nhất thường có ít nhất một phẫu thuật lúc nhỏ. Đôi khi bệnh nhân cũng có thể không có sự can thiệp nào và có thể có tuần hoàn cân bằng với một mức độ hẹp phổi hoặc có tăng áp động mạch phổi. ( Bảng 11.3)
Phần lớn các bệnh nhân đều có triệu chứng khách quan của giảm khả năng gắng sức [26], và những bệnh nhân có phẫu thuật nối tĩnh mạch chủ động mạch phổi sẽ có triệu chứng do tình trạng giảm cung lượng tim mạn tính. Mặc dù vậy, nhiều bệnh nhân cũng có sức khỏe tương đối tốt ít nhất là đến khi 40 tuổi. Vì vậy, nhóm bệnh nhân này cần phải được tư vấn về các vấn đề liên quan đến kế hoạch nghề nghiệp, thai kỳ và ngừa thai.
Phần lớn các bệnh nhân tâm thất độc nhất thường có một mức độ tím. Điều này kể cả với tuần hoàn Fontan hoặc thông nối tĩnh mạch chủ động mạch phổi toàn phần. Trong tuần hoàn Fontan, giảm độ bão hòa Oxy xảy ra do luồng thông tồn lưu , dò ở chỗ miếng vá, hoặc tuần hoàn bàng hệ tĩnh mạch- tĩnh mạch. Tím diễn tiến từ từ trong phẫu thuật Glenn cổ điển do bất thường động tĩnh mạch ở phổi. Các bất thường động tĩnh mạch ở phổi có thể do thiếu hụt “ yếu tố gan” nội tại trong tuần hoàn phổi( sự trở về của tĩnh mạch gan không đến phổi phải). Các bất thường động tĩnh mạch ở phổi có thể giảm dần khi hình thành tuần hoàn gắn kết với hồi lưu tĩnh mạch gan [27]. Những bệnh nhân không phẫu thuật hoặc phẫu thuật Blalock Taussig tạm thời có thể bị tím , đặc biệt là khi gắng sức.
Đa hồng cầu thứ phát ( không phải đa hồng cầu nguyên phát) thuờng gặp ở bệnh nhân có sinh lý kiểu tâm thất độc nhất và bù trừ cho tím khi nghỉ và khi gắng sức. Trích máu thường qui ít có vai trò trong trường hợp này, trong khi xác định tình trạng thiếu sắt và bổ sung chất sắt cần được khuyến khích [28] .
Kết quả lâu dài ở người lớn:
Tâm thất độc nhất sinh lý bao gồm những tổn thương tim bẩm sinh phức tạp nhất làm giảm chất lượng cuộc sống và tuổi thọ, ngay cả khi phẫu thuật tạm thời thành công [29]. Những bệnh nhân không phẫu thuật hoặc phẫu thuật tạm thời tạo luồng thông động mạch hoặc tĩnh mạch về lâu dài cũng sẽ bị tím. Theo thời gian, tím tăng dần có thể do bệnh mạch máu phổi tiến triển hoặc do sự suy yếu của luồng thông được phẫu thuật tạo ra lúc nhỏ. Tím mạn tính gây bệnh lý đa cơ quan, bao gồm cả bệnh đa hồng cầu ( Bảng 11.4)
Tím mạn tính, quá tải tâm thất, và bất thường cấu trúc trong tâm thất từ lúc sinh thường gây ra rối loạn chức năng tâm thu và tâm trương ở các mức độ khác nhau. Hở van nhĩ thất cũng thúc đẩy tình trạng này. Hơn nữa, lưu lượng máu phổi giảm khi có bất thường buồng thoát thất phải cũng làm nặng hơn tình trạng giảm cung lượng tim sẵn có, gây ra những biến chứng của sung huyết thất phải
Bảng 11.4: Các hậu quả trên đa cơ quan của tím mạn tính:
|
Đa hồng cầu Thiếu sắt ( nặng hơn nếu trích máu không thích hợp) Giảm tiểu cầu do giảm chức năng tiểu cầu Bệnh đông máu Huyết khối Tăng độ nhớt máu ( thay đổi trạng thái tâm lý, rối loạn thị giác, mệt mỏi) Suy giảm miễn dịch Nhiễm trùng không điển hình ( Áp- xe não, lao không điển hình) Viêm nội tâm mạc Tiểu máu,tiểu đạm Xơ chai cầu thận Bệnh thận mạn Tăng axit uric máu, Gout Ngón tay dùi trống, phì đại khớp xương Sỏi mật |
Các vấn đề lâu dài liên quan đến tuần hoàn Fontan:
Tuần hoàn Fontan về cơ bản có khiếm khuyết, và theo thời gian, tuần hoàn Fontan sẽ thất bại . Qua nhiều năm, kháng lực mạch máu phổi cũng như áp lực thất cuối tâm trương đều tăng, sự gia tăng này làm giảm tiền tải. Trong tuần hoàn Fontan “ kiểu cũ”, nhĩ phải trở nên rất dày và dãn. Sự chèn ép cục bộ tại các tĩnh mạch phổi phải thường gặp. Nhĩ phải dãn lớn ( có khi tới 10cm đường kính) gây giảm huyết động, rối loạn nhịp và tạo huyết khối
Bất kỳ một tắc nghẽn dòng chảy nào trong tuần hoàn Fontan ( chênh áp 2-3mmHg) cũng đều kém dung nạp và cần phải được điều trị can thiệp. Những tắc nghẽn này, thường ở chỗ nối nhĩ phải động mạch phổi, thường cần phải can thiệp bằng đặt stent [30]. Phẫu thuật đặt van đồng thân ở chỗ xuất phát tuần hoàn Fontan cũng dễ gây tắc nghẽn nên không còn dùng nữa.
Sự tăng mạn tính áp lực tĩnh mạch hệ thống cũng gây bệnh. Sự biến đổi sợi ở gan, nốt Fontan và xơ gan xảy ra sau đó . Tăng áp lực tĩnh mạch cửa và dãn tĩnh mạch thực quản là những biểu hiện muộn [31]. Vấn đề liên quan đến gan có thể là rào cản của sự ghép tim sau này
Bệnh ruột mất protein ( Protein losing enteropathy, PLE) cũng được cho rằng có liên quan một phần đến sự gia tăng áp lực tĩnh mạch mạn tính. Bệnh ruột mất Protein có thể dự báo trước sự khởi đầu một vòng lẩn quẩn của sự quá tải dịch, dinh dưỡng kém, suy giảm miễn dịch và suy thận. Chẩn đoán nghi ngờ khi có biểu hiện lâm sàng ( tràn dịch màng phổi, báng bụng, phù chi, triệu chứng dạ dày ruột) và xác định bằng xét nghiệm albumin máu thấp và tăng alpha-1- antitrypsin trong phân. Bệnh ruột mất protein thường có tiên lượng xấu [32]. Nhiều phương thức điều trị đã được mô tả ( tạo nhịp nhĩ, tạo thông nối ở nhĩ, kiêng ăn các chất có triglyceride chuỗi trung bình giàu protein, dùng thuốc kháng viêm steroide, heparin không phân đoạn mạn tính, Octreotide, Somatostatin, và ngay cả ghép ruột). Không có phương pháp nào luôn luôn chắc chắn.
Mặc dù có nhiều biến chứng được ghi nhận trong phẫu thuật Fontan kiểu cũ, nhưng có vẻ như những biến chứng này cũng sẽ có ở các bệnh nhân làm phẫu thuật tạo đường hầm bên hoặc phẫu thuật Fontan ngoài tim, có lẽ ở tuổi lớn hơn. Khả năng sống 15 năm sau phẫu thuật Fontan kiểu cũ chỉ khoảng 65-70% [33].
Rối loạn nhịp ở bệnh nhân làm phẫu thuật Fontan:
Phần lớn các rối loạn nhịp trong tuần hoàn Fontan là nhịp nhanh xảy ra do vòng vào lại trong nhĩ, gọi là cuồng nhĩ [34] . Rối loạn nhịp nhĩ mới xuất hiện có thể báo hiệu một tổn thương huyết động cơ bản ( như tắc nghẽn trong Fontan), và cần phải được chủ động phát hiện.Cuồng nhĩ cần phải được điều trị cấp cứu ở những bệnh nhân này. Bệnh nhân Fontan nhờ vào sự co bóp đồng bộ nhĩ để làm tăng tối đa lưu lượng máu lên phổi và cung lượng tim hệ thống. Vì vậy, ngay cả cuồng nhĩ chậm tương đối cũng gây bất ổn về huyết động học. Bỏ sót bệnh nhân rối loạn nhịp nhĩ thì đưa đến sự hình thành cục máu đông( như mô tả trong bệnh cảnh lâm sàng ở đầu chương). Trong một thời gian ngắn, sốc điện chuyển nhịp cần thực hiện để duy trì nhịp xoang. Lý tưởng hơn, cần phải làm siêu âm tim qua thực quản để loại trừ huyết khối. Cũng cần phải có một bác sĩ gây mê tim mạch nhiều kinh nghiệm để có thể nhận biết được những tác dụng phụ nghiêm trọng của thông khí áp lực dương.
Khảo sát và cắt đốt điện sinh lý kĩ thuật cao cũng cần phải được xem xét. Cắt đốt trong trường hợp này là một kĩ thuật cao chuyên biệt cần phải có chuyên gia và các kĩ thuật khảo sát và cắt đốt tiên tiến. Rối loạn nhịp là do nhĩ phải dày lên bất thường và sự hiện diện của nhiều vòng vào lại [35]. Sự khởi phát rối loạn nhịp có thể đã tạo nên bàn luận trong phẫu thuật Fontan cải tiến
Bệnh nút xoang cũng thường gặp ở những bệnh nhân làm phẫu thuật Fontan [36], trong khi rối loạn nút nhĩ thất thì thường gặp ở những bệnh nhân tâm thất hai đường vào hoặc có thông liên thất lớn trước đó. Tạo nhịp nhĩ lâu dài có thể cải thiện cung lượng tim và ức chế rối loạn nhịp nhĩ. Tạo nhịp thất thì ít hơn và thường cần hệ thống tạo nhịp thượng tâm mạc
Phẫu thuật Fontan cải tiến:
Từ “ phẫu thuật Fontan cải tiến” để mô tả sự “nâng cấp” phẫu thuật Fontan kiểu cũ nối nhĩ phải động mạch phổi thành phẫu thuật nối tĩnh mạch chủ động mạch phổi toàn phần. Nguyên lý căn bản của phẫu thuật này là thiết lập một tuần hoàn hiệu quả hơn về huyết động học, phòng ngừa và điều trị rối loạn nhịp nhĩ, điều trị chèn ép tĩnh mạch phổi và vì vậy cải thiện được cung lượng tim. Phẫu thuật bao gồm “ loại bỏ” phần lớn nhĩ phải, thực hiện phẫu thuật MAZE cải tiến, và đặt điện cực tạo nhịp thượng tâm mạc phòng ngừa. Tiêu chuẩn chọn lựa và thời gian thực hiện phẫu thuật Fontan cải tiến vẫn còn bàn cải. Tuy nhiên qua bàn tay chuyên gia và với sự lựa chọn tối ưu, các kết quả trung hạn cũng làm hài long [37].
Trường hợp lâm sàng:
Bệnh nhân vẫn còn hạn chế nghiêm trọng mặc dù đã điều trị nội tích cực, sau khi hội chẩn mở rộng, đã được làm phẫu thuật Fontan chuyển đổi thành phẫu thuật nối tĩnh mạch chủ động mạch phổi toàn phần. Đây là phẫu thuật phức tạp và khó khăn có nhiều biến chứng như chảy máu, rối loạn chức năng thận và phải ở lâu trong phòng hồi sức. Sau 12 tháng, bệnh nhân trở về làm việc, Anh được tạo nhịp nhĩ và có suy tim độ 2 theo NYHA.
Tài liệu tham khảo:
- Anderson RH, Becker AE,Wilkinson JL. Proceedings: morphogenesis and nomenclature of univentricular hearts. Br Heart J 1975;37:781–2.
- Khairy P, Poirier N, Mercier L. Univentricular hearts. Circulation 2007;115:800–12.
- Mahle WT, Spray TL, Wernovsky G, et al. Survival after reconstructive surgery for hypoplastic left heart syndrome: a 15-year experience from a single institution. Circulation 2000;102:III136–41.
- Wren C, O’Sullivan J. Survival with congenital heart disease and need for follow up in adult life. Heart 2001;85:438–43.
- Moodie DS, Ritter DG, Tajik AJ, et al. Long-term follow-up in the unoperated univentricular heart. Am J Cardiol 1984:53:1124–8.
- Marelli AJ, Mackie AS, Ionescu-Ittu R, et al. Congenital heart disease in the general population: changing prevalence and age distribution. Circulation 2007;115:163–72.
- Whittemore R, Wells JA, Castellsague X. A second-generation study of 427 probands with congenital heart defects and their 837 children. J Am Coll Cardiol 1994:23:1459–67.
- Gill HK, Splitt M, Sharland GK, Simpson JM. Patterns of recurrence of congenital heart disease: an analysis of 6,640 consecutive pregnancies evaluated by detailed fetal echocardiography. J Am Coll Cardiol 2003;42:923–9.
- Alonso S, Pierpont ME, RadtkeW, et al. Heterotaxia syndrome and autosomal dominant inheritance. Am J Med Genet 1995;56:12–15.
- Marino B, Digilio MC, Novelli G, et al. Tricuspid atresia and and 22q11 deletion. Am J Med Genet 1997;72:40–2.
- Shinebourne EA, Macartney FJ, Anderson RH. Sequential chamber localization– logical approach to diagnosis in congenital heart disease. Br Heart J 1976;38:327–40.
- Park SJ, Kwak CH, Hwang JY. Long-term survival in double inlet left ventricle combined with pulmonary stenosis and parachute mitral valve: a rare case. Int Heart J 2007;48:261–7.
- Tibballs J, Kawahira Y, Carter BG, et al. Outcomes of surgical treatment of infants with hypoplastic left heart syndrome: an institutional experience 1983-2004. J Paediatr Child Health 2007;43:746–51.
- Blalock A, Taussig HB. The surgical treatment of malformations of the heart in which there is pulmonary stenosis or pulmonary atresia. J Am Med Assoc 1945;128:189–92.
- Glenn WWL. Circulatory bypass of the right side of the heart, IV: shunt between superior vena cava and distal right pulmonary artery: report of clinical application. N Engl J Med 1958;259:117–20.
- Fontan F, Baudet E. Surgical repair of tricuspid atresia. Thorax 1971;26:240–8.
- de Leval MR, Kilner P, Gewillig M, Bull C. Total cavopulmonary connection:a logical alternative to atriopulmonary connection for complex Fontan operations: experimental studies and early clinical experience. J Thorac Cardiovasc Surg 1988;96:682–95.
- Choussat A, Fontan F, Besse B, et al. Selection criteria for Fontan’s procedure. In: Paediatric Cardiology. New York: Churchill Livingstone, 1978:559–66.
- Stasik CN, Goldberg CS, Bove EL, Devaney EJ, Ohye RG. Current outcomes and risk factors for the Norwood procedure. J Thorac Cardiovasc Surg 2006;131:412–17.
- Jensen RA Jr, Williams RG, Laks H, et al. Usefulness of banding of the pulmonary trunk with single ventricle physiology at risk for subaortic obstruction. Am J Cardiol 1996;77:1089–93.pter 11 Single ventricle physiology 173
- Polderman FN, Cohen J, BlomNA, et al. Sudden unexpected death in children with a previously diagnosed cardiovascular disorder. Int J Cardiol 2004;95:171–6.
- Rao PS. Tricuspid atresia. Curr Treat Options Cardiovasc Med 2000;2:507–20.
- Veldtman GR, Nishimoto A, Siu S, et al. The Fontan procedure in adults. Heart 2001;86:330–5.
- Sadiq M, St ¨umper O, De Giovanni JV, et al. Management and outcome of infants and children with right atrial isomerism. Heart 1996;75:314–19.
- Lim JS, McCrindle BW, Smallhorn JF, et al. Clinical features, management, and outcome of children with fetal and postnatal diagnoses of isomerism syndromes. Circulation 2005;112:2454–61.
- Iserin L, Chua TP, Chambers J, Coats AJ, Somerville J. Dyspnoea and exercise intolerance during cardiopulmonary exercise testing in patients with univentricular heart. The effects of chronic hypoxaemia and Fontan procedure. Eur Heart J 1997;18: 1350–6.
- Lee J, Menkis AH, Rosenberg HC. Reversal of pulmonary arteriovenous malformation after diversion of anomalous hepatic drainage. Ann Thorac Surg 1998;65:848–9.
- Spence MS, Balaratnam MS, Gatzoulis MA. Clinical update: cyanotic adult congenital heart disease. Lancet 2007:370:1530–2.
- Oechslin EN, Harrison DA, Connelly MS,Webb GD, Siu SC. Mode of death in adults with congenital heart disease. Am J Cardiol 2000;86:1111—16.
- Shahda S, Zahra M, Fiore A, Jureidini S. Stents in the successful management of protein-losing enteropathy after fontan. J Invasive Cardiol 2007;19:444–6.
- Kiesewetter CH, Sheron N, Vettukattill JJ, et al. Hepatic changes in the failing Fontan circulation. Heart 2007;93:579–84.
- Khairy P, Fernandes SM, Mayer JE Jr, et al. Long-term survival, modes of death, and predictors of mortality in patients with Fontan surgery. Circulation 2008;117:85–92.
- Fontan F, Kirklin JW, Fernandez G, et al. Outcome after a “perfect” Fontan operation. Circulation 1990;81:1520–36.
- Gelatt M, Hamilton RM, McCrindle BW, et al. Risk factors for atrial tachyarrhythmias after the Fontan operation. J Am Coll Cardiol 1994;24:1735–41.
- Abrams DJ, Earley MJ, Sporton SC, et al. Comparison of noncontact and electroanatomic mapping to identify scar and arrhythmia late after the Fontan procedure. Circulation 2007;370:1530–2.
- Cohen MI, Wernovsky G, Vetter VL, et al. Sinus node function after a systematically staged Fontan procedure. Circulation 1998;98:II352–8.
- Mavroudis C, Backer CL, Deal BJ, Johnsrude C, Strasburger J. Total cavopulmonary conversion and maze procedure for patients with failure of the Fontan operation. J Thorac Cardiovasc Surg 2001;122:863–71.

Để lại bình luận
Bạn cần phải đăng nhập để đăng bình luận.