Naser M. Ammash
Người dịch: BS. Đan
Một phụ nữ 24 tuổi biết thông liên thất từ nhỏ đến khám bệnh vì khó thở khi gắng sức, mệt mỏi, và đau ngực không điển hình. Cô ta cho biết không bị khó thở khi nằm, khó thở về đêm hoặc phù. Thăm khám lâm sàng ghi nhận huyết áp 120/70mmHg, nhịp tim 56 lần/phút. Áp lực tĩnh mạch cổ và mạch cảnh bình thường. Phổi trong. Khám tim không ghi nhận ổ đập bất thường hoặc rung miu. Tiếng tim bình thường, không có T3 hoặc T4. Có âm thổi toàn tâm thu cường độ 3/6 tại mỏm và bờ trái xương ức, không âm thổi tâm trương. Các bộ phận khác bình thường, không phù, không có hiện tượng dùi trống hoặc tím tái ở chi dưới. Điện tâm đồ và X quang ngực không ghi nhận gì đặc biệt, không dấu hiệu lớn thất trái.
Ca lâm sàng này minh hoạ một trường hợp thường gặp ở người trưởng thành có thông liên thất (TLT) đơn thuần. Thông liên thất khác nhau về kích thước, vị trí và có thể có biến chứng suy tim, viêm nội tâm mạc nhiễm trùng, hở van động mạch chủ (ĐMC), tăng áp động mạch phổi, hay tắc nghẽn đường thoát thất phải do hẹp van động mạch phổi hoặc thất phải hai buồng [1]. Việc điều trị trường hợp lâm sàng trên đòi hỏi kiến thức cơ bản về các dạng khác nhau của TLT và những biến chứng có thể gặp. Việc tiếp cận chẩn đoán phải đánh giá hết những điểm đặc trưng của bệnh và sẽ giúp ích cho việc chăm sóc những bệnh nhân bị dị tật này, một trong những loại dị tật bẩm sinh thường gặp nhất.
GIẢ PHẪU HỌC VÀ SINH LÝ BỆNH
Vách liên thất là một vách ngăn ba chiều, không bằng phẳng phân chia quả tim thành 5 phần: màng, phễu (hay dưới động mạch), buồng nhận, cơ (hay cơ bè), và vách nhĩ thất (Hình 4.1).
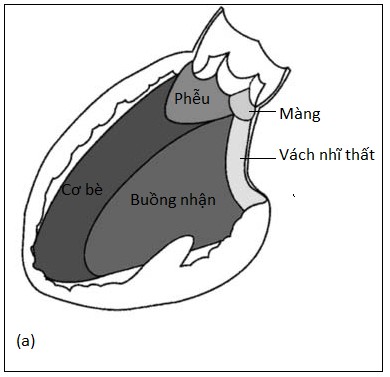
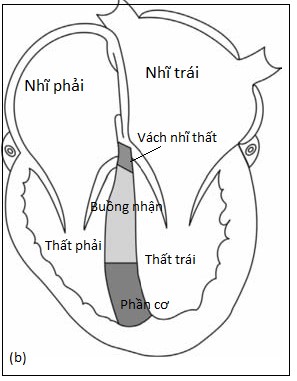
Hình 4.1: Sơ đồ minh hoạ những thành phần khác nhau của vách liên thất (a) nhìn từ thất trái, (b) nhìn từ mỏm: phần màng, phần phễu, phần cơ bè, buồng nhận, vách nhĩ thất.
(b) 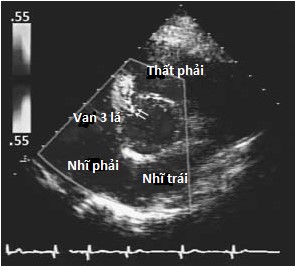
(c) 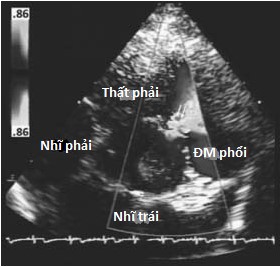
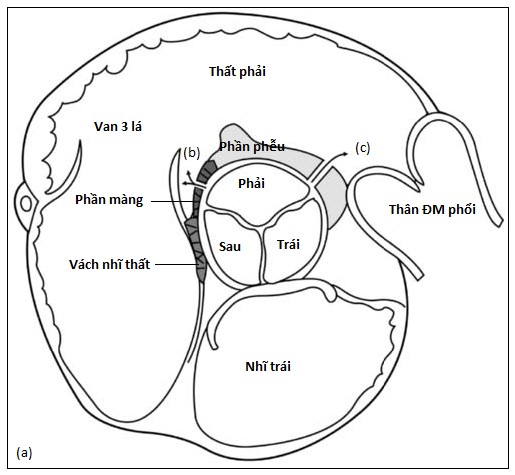
Hình 4.2 :(a) Mặt cắt trục ngang cạnh ức cho thấy, phần màng, phần phễu, vách nhĩ thất và vị trí của thông liên thất phần màng và thông liên thất trên mào hoặc dưới động mạch. (b) Doppler màu cho thấy thông liên thất phần màng với luồng thông trái phải ở cạnh van ba lá (dòng màu đỏ đi từ thất trái sang thất phải). (c) Doppler màu cho thấy thông liên thất trên mào hoặc dưới động mạch ở buồng tống thất phải cạnh van động mạch phổi.
Sự phát triển một cách khiếm khuyết hoặc kết nối không hoàn toàn của các thành phần này gây ra các loại TLT được phân loại tương ứng như TLT phần màng (Hình 4.2), phần phễu (còn được gọi là dưới động mạch hay trên mào; Hình 4.2&4.3), buồng nhận, phần cơ, và nhĩ thất (còn có tên là Gerbode) [2,3]. Thông liên thất phần màng, loại thông liên thất thường gặp nhất (80%), nằm dưới van ĐMC và nằm cạnh lá vách của van 3 lá (Hình 4.2). Nó có thể lan đến phần vách cơ (TLT quanh màng) và có thể đi kèm với hở van ĐMC do sa lá vành phải hoặc lá không vành. Ở người trưởng thành, TLT loại này thường kết hợp với hiện tượng phát triển mô của lá vách van 3 lá gây ra đóng một phần hoặc hoàn toàn lỗ thông liên thất (chiếm đến 60% trường hợp) và, có khi gây ra phình vách màng. TLT phần màng cũng có thể đi kèm biến chứng thất phải hai buồng (3-10% trường hợp) do sự phì đại của các bó cơ bất thường do tác động của dòng máu đi qua TLT, chia thất phải thành hai buồng: buồng gần áp lực cao và buồng xa dưới van động mạch phổi áp lực thấp (Hình 4.4) [4].
TLT phần phễu (5-7% các trường hợp TLT ở Hoa Kỳ, 30% các trường hợp ở Đông Nam Á) là một loại thông liên thất nằm ngay dưới van động mạch phổi và van ĐMC [2]. Các TLT này không đóng một cách tự nhiên nhưng có thể nhỏ đi do sự sa của lá vành phải hoặc lá vành trái và kèm theo sự gia tăng nguy cơ hở van ĐMC (Hình 4.2&4.3). Nguy cơ hở van ĐMC tăng theo tuổi (87% bệnh nhân từ 20 tuổi trở lên) và gấp 2,5 lần so với TLT phần màng do sự khiếm khuyết hay thiểu sản bờ trên của vách chóp nằm rất sát các lá van bán nguyệt [1,2,5,6]. TLT buồng nhận là loại TLT lớn làm tách rời van 2 lá và van 3 lá, nằm dưới cả 2 lá van nhĩ thất, và lan đến chỗ bám dây chằng của van 3 lá. Mặc dù nằm gần các van nhĩ thất, loại TLT này không đi kèm với hở van 2 lá hoặc hở van 3 lá trừ khi nằm trong bệnh cảnh kênh nhĩ thất [7]. Khi không được sửa chữa, loại TLT này ở người trưởng thành thường đi kèm tăng áp động mạch phổi. TLT phần cơ (5-20% TLT) có thể nhỏ hoặc lớn, một lỗ hoặc nhiều lỗ, và nằm bất cứ nơi nào trên vách liên thất. Cuối cùng, thông nhĩ thất là một loại khiếm khuyết hiếm gặp của vách nhĩ thất đưa đến luồng thông từ thất trái sang nhĩ phải, đã được báo cáo sau khi bị viêm nội tâm mạc và có thể đi kèm hở van 3 lá và suy nút xoang [8,9].
Hướng và độ nặng của luồng thông từ trái sang phải tạo ra bởi TLT phụ thuộc vào kích thước của lỗ thông, áp lực hệ thống, và sự hiện diện của hở van ĐMC, thất phải 2 buồng, và tăng áp ĐM phổi. Ở người trưởng thành, luồng thông chủ yếu là trong thì tâm thu và từ trái sang phải khi không có tăng áp động mạch phổi nặng hoặc tắc nghẽn buồng tống thất phải. Sự tăng tải thể tích làm ảnh hưởng động mạch phổi, nhĩ trái và thất trái. Nhĩ phải có thể lớn khi có sự tăng áp lực (tăng áp động mạch phổi, thất phải 2 buồng) hoặc tăng tải thể tích (hiệu ứng Gerbode). Sự hiện diện của hở van ĐMC, thất phải 2 buồng, và tăng áp ĐM phổi cũng ảnh hưởng đến độ nặng của luồng thông và ảnh hưởng đến sự điều trị những bệnh nhân này. Khi có bệnh lý tắc nghẽn mạch máu phổi nặng do luồng thông lớn từ trái sang phải kéo dài, áp lực thất phải bằng hoặc gần bằng áp lực hệ thống; hậu quả là chỉ có một luồng thông tối thiểu qua lỗ TLT và có lúc luồng thông đảo chiều kèm theo tím tái. Hiện tượng luồng thông từ phải sang trái này được gọi là phức hợp Eisenmenger xảy ra trong 10-15% các bệnh nhân bị TLT, hầu hết xảy ra ở thập niên thứ 2 hoặc thứ 3 của cuộc đời [2,10]. Ngược lại, sự hiện diện của hẹp động mạch phổi nặng hoặc thất phải hai buồng làm hạn chế dòng máu lên phổi và ngăn cản tăng áp động mạch phổi, đổi lại thất phải bị phì đại và tắc nghẽn buồng tống. Cuối cùng, sự hiện diện của hở van ĐMC do sa một lá vành có thể đưa đến việc giảm kích thước lỗ thông và giảm luồng thông trái phải, với cái giá phải trả là biến dạng van ĐMC, hở van ĐMC, và tăng tải thể tích thất trái.
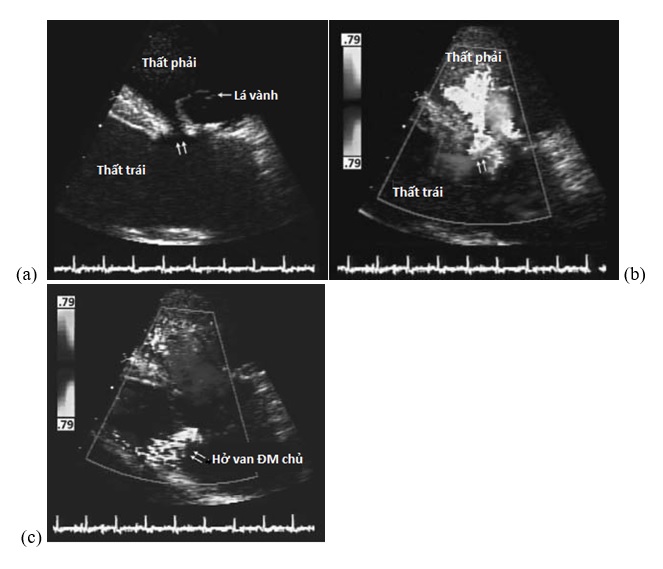
Hình 4.3. Siêu âm tim qua thành ngực cho thấy TLT trên mào có hoặc không có dòng Doppler màu trong thì tâm thu và tâm trương. Ghi nhận hình ảnh sa van ĐMC trong thì đầu tâm thu (a), khi máu được tống đi từ thất trái, lá vành và xoang vành không được nâng đỡ về mặt giải phẫu học bị sa vào thất phải do hiệu ứng Venturi. Hình ảnh dòng Doppler màu cho thấy luồng thông từ trái sang phải ngang qua lỗ TLT (b). Trong thì tâm trương (c), áp lực trong ĐMC làm cho các lá van ĐMC đóng lại, nhưng lá vành phải hoặc lá không vành không được nâng đỡ bị đẩy vào buồng tống thất trái nhiều hơn lá vành còn lại, đưa đến hở van ĐMC.
TIẾP CẬN THỰC TẾ ĐỐI VỚI THÔNG LIÊN THẤT Ở NGƯỜI TRƯỞNG THÀNH
Người trưởng thành có TLT đơn độc thường thể hiện dưới dạng một TLT lỗ nhỏ có luồng thông trái phải hạn chế (bệnh Roger) hay có thể là một TLT lớn đã bị đóng một phần do sự tăng sinh cơ sợi hoặc do sự dính của lá vách van ba lá hoặc do phì đại vách liên thất. Tùy vào kích thước và loại TLT, và những biến chứng đi kèm, mà bệnh nhân có thể không có triệu chứng, hoặc có thể khó thở hay mệt mỏi, suy tim, viêm nội tâm mạc nhiễm trùng, ngất, loạn nhịp, hoặc đột tử [1,2,11]. Ngất thường xảy ra khi gắng sức và có thể do loạn nhịp hoặc tắc nghẽn buồng tống thất phải nặng do sa nặng lá van động mạch chủ, phình vách màng lớn, hoặc thất phải 2 buồng. Bệnh nhân có thể biểu hiện bằng một âm thổi thay đổi; một âm thổi mới, ví dụ như âm thổi tâm trương do hở van ĐMC; hoặc suy tim do tăng tải thể tích thất trái tiến triển và/hoặc tăng áp động mạch phổi. Những bệnh nhân có tăng áp động mạch phổi nặng hoặc tắc nghẽn buồng tống thất phải do hẹp động mạch phổi hoặc thất phải hai buồng khi bước vào tuổi thiếu niên có thể biểu hiện những triệu chứng gây nhầm lẫn với hen phế quản ở trẻ em, như khó thở, kém khả năng gắng sức, và tím tái.
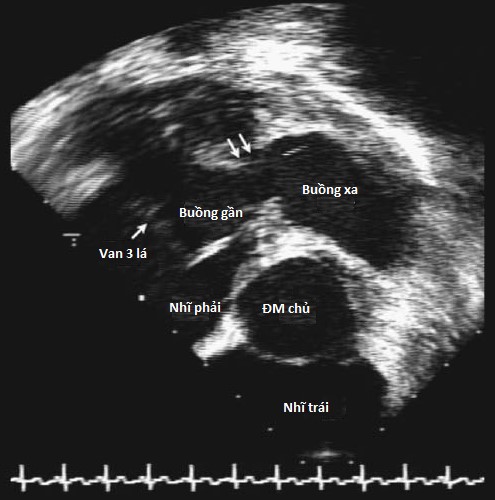
Hình 4.4 :Hình ảnh siêu âm tim qua thực quản với mặt cắt tại đáy tim cho thấy phì đại thành thất phải của một trường hợp thất phải 2 buồng với buồng gần áp lực cao và buồng xa áp lực thấp.
Hầu hết TLT có thể xác định được bằng cách nghe tim, tuỳ vào kích thước và những biến chứng đi kèm (Hình 4.5). Rung miu sờ được ở khoảng gian sườn 3 và 4 không phải là hiếm gặp ở những trường hợp TLT nhỏ hay những trường hợp có kèm thất phải hai buồng. Âm thổi TLT điển hình thường thô và toàn tâm thu và nghe rõ nhất ở khoảng gian sườn 3 và 4 trái. Tuy nhiên, một âm thổi tâm thu dạng giảm dần cường độ (decrescendo) chấm dứt trước tiếng tim thứ 2 đôi khi nghe được trong trường hợp TLT phần cơ nhỏ do tắc nghẽn hoàn toàn lỗ TLT trong phần lớn kỳ tâm thu. Một âm thổi tâm thu dạng phụt lớn ở bờ trái xương ức gợi tắc nghẽn buồn tống thất phải nặng và có thể làm mờ đi âm thổi toàn tâm thu của TLT. Sự hiện diện ổ đập ở cạnh ức trái và rung miu gợi ý thất phải hai buồng. Ngược lại, một tiếng click giữa tâm thu kèm theo một âm thổi cuối tâm thu hướng nghĩ đến phình vách màng. Những dấu hiệu khác khi thăm khám có tầm quan trọng về mặt lâm sàng bao gồm sự hiện diện sóng A của tĩnh mạch cổ do phì đại và giảm độ đàn hồi thất phải khi có tắc nghẽn buồng tống thất phải hoặc tăng áp động mạch phổi nặng. Tình trạng tăng áp động mạch phổi nặng có thể đi kèm với những dấu hiệu thăm khám khác bao gồm: (1) sóng V và âm thổi tâm thu tăng khi hít vào đi kèm với suy thất phải và hở van 3 lá, (2) click tâm thu động mạch phổi do dãn động mạch phổi, (3) tiếng đóng van động mạch phổi lớn có thể sờ được, (4) mất âm thổi toàn tâm thu điển hình của TLT do áp lực thất phải bằng áp lực hệ thống làm mất luồng thông trái phải, và (5) âm thổi tâm trương của hở van động mạch phổi có thể nghe thấy ở phần trên bờ ức trái.
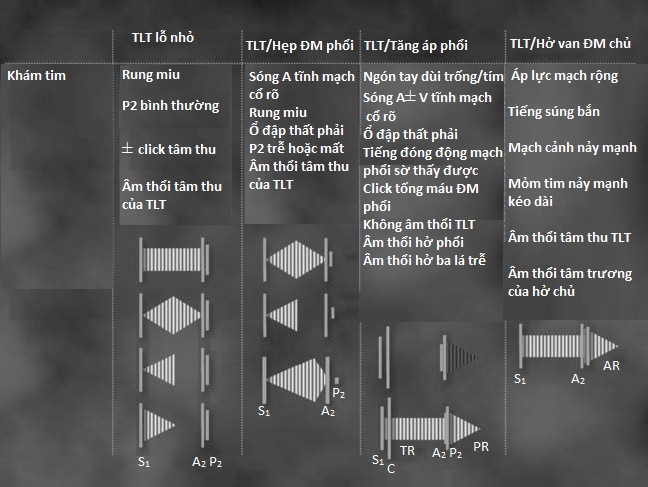
Hình 4.5 :Hình ảnh minh hoạ thăm khám tim trong trường hợp TLT lỗ nhỏ, TLT có hẹp động mạch phổi, TLT có tăng áp động mạch phổi, và TLT có hở van ĐMC. Để ý rằng âm thổi toàn tâm thu điển hình trong TLT lỗ nhỏ bắt đầu sau tiếng tim thứ nhất (S1) và có thể ngắn đi khi TLT ở phần cơ. Khi có hẹp động mạch phổi, âm thổi có thể có dạng tống máu thì tâm thu do hẹp động mạch phổi nặng kèm với tiếng đóng của van động mạch phổi nhỏ và trễ (P2). Khi TLT có biến chứng tăng áp động mạch phổi (Hội chứng Eisenmenger), không có âm thổi TLT nhưng có tiếng click tống máu động mạch phổi (C), tiếng P2 lớn sờ được và âm thổi tâm trương của hở động mạch phổi (PR). Nếu những bệnh nhân này có hở van 3 lá (TR), thì có thể nghe thấy một âm thổi toàn tâm thu ở phần dưới cạnh xương ức. Cuối cùng, khi có hở van ĐMC, sau âm thổi TLT sẽ có tâm thổi tâm trương của hở van ĐMC (AR). Âm thổi tâm trương này bắt đầu sau tiếng đóng van ĐMC (A2).
Điện tâm đồ 12 chuyển đạo ghi nhận bình thường trong 66% trường hợp [12]. Chậm dẫn truyền trong thất không đặc hiệu và blốc nhánh phải là những bất thường thường gặp nhất ở những bệnh nhân có TLT đơn độc. Sự hiện diện của trục lệch phải, lớn nhĩ phải, hay lớn thất phải là dấu hiệu gợi tăng áp động mạch phổi nặng hoặc thất phải hai buồng. Mặt khác, sự hiện diện dấu hiệu điện tâm đồ của lớn nhĩ trái, lớn thất trái, và/ hoặc phì đại thất trái không phải là hiếm gặp khi có quá tải thể tích thất trái do luồng thông của TLT và/hoặc hở van ĐMC kèm theo.
Hình ảnh bóng tim và mạch máu phổi bình thường trên X-quang ngực là dấu hiệu của TLT nhỏ, không biến chứng. Ngược lại, hình ảnh bóng tim to với phình cung của thất trái liên quan trực tiếp với độ nặng của luồng thông và thường thấy khi tỉ lệ dòng máu chủ/phổi [Qp/Qs]>2. Ít gặp hơn, thất trái dãn là do hở van ĐMC. Ngược lại, hình ảnh bóng tim to với phình cung của thất phải và lớn nhĩ phải là dấu hiệu gợi tăng áp động mạch phổi hoặc tắc nghẽn buồng tống thất phải nặng. Khi có phức hợp Eisenmenger, hình ảnh X-quang ngực cũng cho thấy động mạch phổi dãn lớn với cắt cụt mạch máu phổi ở ngoại vi, trong khi đó khi có tắc nghẽn buồng tống thất phải, mạch máu phổi thường giảm.
SIÊU ÂM TIM
Thăm khám siêu âm kỹ luỡng là trắc nghiệm chẩn đoán không xâm nhập quan trọng nhất dùng để đánh giá TLT, các khiếm khuyết bẩm sinh phối hợp, và những biến chứng có thể có. Siêu âm tim có độ nhạy cao nhất đối với những TLT lớn hơn 5mm, nằm ở phần màng, buồng nhận, hay vùng phễu; nó ít nhạy hơn đối với thông liên thất vùng mỏm. Vách liên thất và các cấu trúc chung quanh có thể thấy rõ ở nhiều mặt cắt bằng cách sử dụng dòng màu và phổ Doppler. Mặt cắt cạnh ức trục dọc cho phép nhìn rõ các TLT phần cơ, phần màng và phần phễu. TLT phần màng và phần phễu thường thấy nằm dưới van động mạch chủ và đôi khi rất khó phân biệt với nhau nếu không dùng mặt cắt cạnh ức trục ngang, mặt cắt này cho thấy rõ ràng TLT phần màng nằm gần van 3 lá, trong khi TLT phần phễu nằm dưới van động mạch phổi (Hình 4.2). Mặt cắt cạnh ức trục ngang cũng cho phép thấy phình vách màng và giúp đánh giá thất phải hai buồng và/hoặc hở van ĐMC. Các mặt cắt từ mỏm được dùng để đánh giá thông liên thất buồng nhận, phần cơ và thông nối nhĩ thất. Nó thuờng là mặt cắt tốt nhất để lấy được tín hiệu vận tốc dòng hở van 3 lá rõ ràng, không nhiễu, cho phép ước lượng chính xác áp lực tâm thu thất phải và động mạch phổi [13]. Nếu không thể lấy được tín hiệu rõ ràng, có thể đo áp lực tâm trương hoặc áp lực trung bình động mạch phổi bằng cách sử dụng vận tốc và thời gian gia tốc của dòng hở phổi [14,15]. Phân tích dòng màu và phổ Doppler, khi đo ngang qua lỗ TLT, có thể xác định độ nặng và hướng luồng thông. Tín hiệu vận tốc Doppler liên tục ≥4m/s là dấu gợi TLT lỗ nhỏ với luồng thông trái phải hạn chế khi không có tăng áp lực hệ thống đáng kể. Ngược lại, giá trị nhỏ hơn được ghi nhận khi có thất phải 2 buồng, hẹp động mạch phổi, hoặc tăng áp phổi. Trong những tình trạng này, áp lực thất phải gia tăng và hậu quả là sự khác biệt áp lực giữa thất trái và thất phải bị giảm đi đưa đến độ chênh áp qua lỗ TLT giảm. Cuối cùng, thăm khám siêu âm tim có thể giúp ích việc đánh giá tình trạng quá tải thể tích; chẳng hạn như kích thước thất trái bình thường gợi ý luồng thông trái phải nhỏ, trong khi đó hình ảnh lớn thất trái, lớn nhĩ trái, dãn động mạch phổi gợi ý luồng thông trái phải lớn. Như vậy, thăm khám siêu âm tim kỹ lưỡng sẽ cho phép xác định chính xác các đặc điểm hình thái học của lỗ thông kích thước và bờ của nó; cho phép đánh giá chính xác về mặt huyết động độ nặng của luồng thông và tình trạng quá tải thể tích của nhĩ trái và thất trái; đánh giá sự hiện điện và độ nặng của thất phải hai buồng, hở van động mạch chủ, tăng áp động mạch phổi, phình vách màng [1,16-20]. Hơn nữa, siêu âm tim định kỳ cho phép đánh giá tiến triển của tổn thương và các biến chứng đi kèm. Điều này có ứng dụng rất quan trọng về mặt tiên lượng, đặc biệt là giúp xác định thời điểm cản thiệp hoặc sửa chữa về mặt ngoại khoa. Siêu âm tim qua thực quản được dành cho bệnh nhân có cửa sổ siêu âm qua thành ngực kém.
NHỮNG TRẮC NGHIỆM CHẨN ĐOÁN PHỤ TRỢ
Do đặc tính thích nghi và nghèo nàn triệu chứng ở những bệnh nhân trưởng thành có bệnh tim bẩm sinh mà không ít trường hợp người thầy thuốc phải dựa vào trắc nghiệm gắng sức để đánh giá những thay đổi khả năng gắng sức trong suốt một thời gian dài, nhằm giúp ích cho việc xác định thời điểm can thiệp tối ưu. Một sự sa sút khả năng gắng sức không giải thích được có thể là một dấu hiệu sớm của sự suy giảm chức năng, thậm chí khi không có các triệu chứng tim mạch.
Hình ảnh cộng hưởng từ hạt nhân gần đây được xem như một kỹ thuật chính xác và đáng tin cậy trong việc đánh giá cấu trúc và chức năng tim. Kỹ thuật này có những ưu điểm so với siêu âm tim; hình ảnh không bị ảnh hưởng bởi khí, xương hay sẹo phẫu thuật, cho phép đánh giá một cách không hạn chế các buồng tim. Việc áp dụng quy tắc Simpson đối với các nhát cắt trong thì tâm thu và tâm trương cho phép đo đạc chính xác và trực tiếp thể tích và chức năng thất trái. Hơn nữa, hình ảnh cản quang theo pha (phase contrast) cung cấp một phương pháp chính xác để đánh giá tốc độ, thể tích và kiểu dòng máu chảy, điều này sẽ cho phép đo đạc chính xác dòng máu động mạch phổi thì tâm thu và tâm trương và tính toán độ nặng của luồng thông [21]. Tuy nhiên, cho đến này, kỹ thuật này chưa được công nhận rộng rãi trong việc đánh giá TLT và có những bất lợi của việc tiếp xúc chất phóng xạ.
Thông tim và chụp thất trái đồ được thực hiện bằng cách bơm một lượng lớn chất cản quang trong một thời gian ngắn là một kỹ thuật hỗ trợ quan trọng thường được dành để đánh giá những trường hợp TLT mà còn nghi ngờ về mức độ ảnh hưởng huyết động học. Nó cũng rất hữu ích trong việc đánh giá TLT có biến chứng, chẳng hạn như TLT nhiều lỗ và đặc biệt là TLT ở phần mỏm, vách nhĩ thất, hoặc TLT kết hợp với thất phải 2 buồng, hở van ĐMC, hoặc tăng áp ĐM phổi. Thông tim có thể đánh giá chính xác hướng và độ nặng của luồng thông bằng cách dựa vào hình ảnh chụp mạch máu, đường cong pha loãng chất chỉ thị, hay tính toán tỉ lệ lưu lượng máu phổi chủ (Qp/Qs) bằng cách đo nồng độ oxy máu [7,11,16,22]. Khi có thất phải 2 buồng hoặc hẹp động mạch phổi, kỹ thuật này có thể đo đạc một cách đáng tin cậy áp lực ở những phần khác nhau thất phải và động mạch phổi. Những số liệu này rất có ý nghĩa trong việc điều trị. Tương tự như vậy, thông tim cũng là phương pháp khảo sát được chọn lựa trong việc đánh giá TLT có tăng áp động mạch phổi để xác định chính xác áp lực động mạch phổi, kháng lực mạch máu phổi và khả nặng hồi phục khi đáp ứng với oxygen, thuốc dãn mạch hoặc khí NO. Điều này rất quan trọng trong việc quyết định tính thích hợp của việc can thiệp phẫu thuật. Cuối cùng, đối với những bệnh nhân nghi ngờ hở van ĐMC chụp động mạch chủ cho phép phát hiện sa van ĐMC và giúp phân độ nặng của hở van ĐMC.
CHỈ ĐỊNH CAN THIỆP
Sự đóng kín tự nhiên được báo cáo trong 50-70% trường hợp TLT phần màng và phần cơ và xảy ra chủ yếu ở tuổi nhỏ, nhưng cũng được ghi nhận ở 10% trường hợp người trưởng thành từ 17 đến 45 tuổi [2,24]. TLT không tự đóng có thể đưa đến loạn nhịp, suy tim, hở van ĐMC, tăng áp động mạch phổi, và viêm nội tâm mạc nhiễm trùng; do đó, việc đánh giá định kỳ được khuyến cáo để xác định thời điểm can thiệp tối ưu. Hiệp hội Tim mạch Hoa kỳ không khuyến cáo dùng kháng sinh phòng ngừa trong những trường hợp TLT không biến chứng và không có tiền sử viêm nội tâm mạc nhiễm trùng [25]. Những bệnh nhân có thông liên thất lỗ nhỏ, đơn thuần, không biến chứng, đặc biệt là TLT phần màng và phần cơ, sống rất tốt miễn là không bị quá tải thể tích buồng tim trái. Trong một nghiên cứu của Gabriel [26] trên 222 bệnh nhân (tuổi trung bình trong lần theo dõi cuối cùng là 30±10 năm), chỉ một bệnh nhân cần phẫu thuật. Như vậy, việc theo dõi liên tục được khuyến cáo đối với TLT lỗ nhỏ, đơn thuần cho đến khi bệnh nhân có triệu chứng hoặc bị dãn thất trái không giải thích được hoặc giảm khả năng gắng sức khi làm trắc nghiệm gắng sức (<70%). TLT lỗ vừa hoặc lỗ lớn, khi gặp ở người trưởng thành, hầu như luôn đi kèm tăng áp động mạch phổi ở một mức độ nào đó. Ngoại lệ là những TLT đã trở nên nhỏ hơn do sa lá van ĐMC trong hở van ĐMC hay những trường hợp có hẹp động mạch phổi đi kèm gây tăng áp thất phải và làm hạn chế luồng thông trái phải.
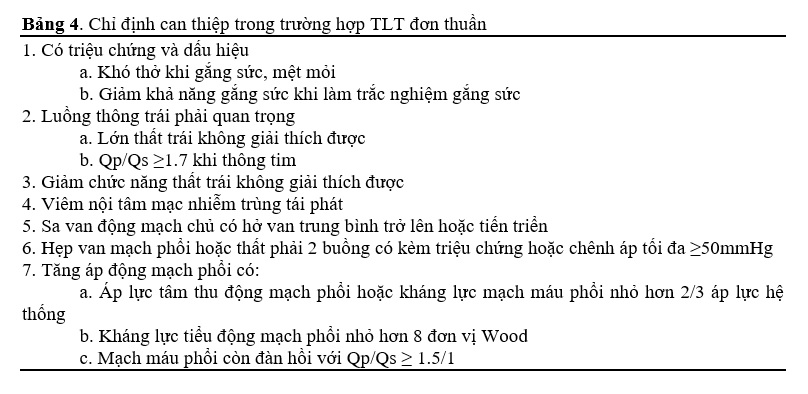
Chỉ định can thiệp TLT ở người trưởng thành được tóm tắt trong bảng 14.1. Thời điểm phẫu thuật tối ưu ở bệnh nhân TLT kèm hở van ĐMC còn bàn cãi. Những khuyến cáo hiện tại đối với thay van trong hở van ĐMC đơn thuần không áp dụng được cho những bệnh nhân này, và sửa chữa ngoại khoa TLT kèm hở van ĐMC không nên trì hoãn cho đến khi có dãn lớn hoặc rối loạn chức năng thất trái [27]. Tính khả thi và chỉ định của việc can thiệp sớm, bao gồm đóng lỗ TLT và sửa van ĐMC, phụ thuộc vào loại TLT (dưới động mạch hay phần màng), kích thước lỗ thông, và mức độ biến dạng van; kết quả thường tốt hơn ở những bệnh nhân trẻ [28-33]. Ở những bệnh nhân không thể sửa van động mạch chủ do biến dạng quá mức, thủng van, hoặc xơ hoá, vôi hoá nặng, cần xem xét thay van [6]. Việc lựa chọn van nhân tạo tuỳ vào tuổi của bệnh nhân và bệnh lý đi kèm.
Việc phẫu thuật đóng TLT làm giảm nguy cơ viêm nội tâm mạc nhiễm trùng ít nhất là phân nửa, giảm áp lực động mạch phổi, cải thiện khả năng gắng sức, và cải thiện sống còn dài hạn [12,34-36]. Tử vong do phẫu thuật đối với TLT không biến chứng là dưới 2% [11]. Tỉ lệ này gia tăng trong trường hợp nhiều lỗ thông, tăng áp phổi trung bình (>50% áp lực hệ thống), và khi có hở van ĐMC [12,36].
Gần đây, người ta quan tâm nhiều hơn đến việc đóng TLT bằng dụng cụ qua ngả thông tim [37,38]. Phương pháp này đã được thực hiện thành công ở trẻ em cũng như ở người lớn và có thể được xem như là một chọn lựa điều trị đối với TLT phần cơ hoặc phần màng đơn độc, không biến chứng khi có giải phẫu học thích hợp. Mới đây, Butera báo cáo kinh nghiệm trên 104 bệnh nhân có TLT phần màng. TLT được đóng thành công ở 100 bệnh nhân (96%). Tỉ lệ đóng kín hoàn toàn là 47% ngay sau thủ thuật, nhưng tăng đến 99% sau thời gian theo dõi trung bình là 38,5 tháng [37]. Kỹ thuật phi ngoại khoa đầy hứa hẹn này cũng có thể được dùng để sửa chữa thông nối thất nhĩ (khiếm khuyết Gerbode). Tuy nhiên cần đánh giá kỹ lưỡng sự kề cận của hệ thống dẫn truyền, van động mạch chủ và van 3 lá đối với bờ của lỗ thông, và sự chồng chéo cũng các cấu trúc lân cận như động mạch chủ và van động mạch chủ trước khi quyết định sử dụng kỹ thuật này. Trong báo cáo của Butera tỉ lệ blốc nhĩ thất hoàn toàn cần đặt máy tạo nhịp là 6% [37].
TIÊN LƯỢNG
Tiên lượng của bệnh nhân bị TLT đơn thuần rất thuận lợi trừ phi bị biến chứng tăng áp phổi. Những bệnh nhân không triệu chứng có TLT lỗ nhỏ, kích thước và chức năng thất trái bình thường có tiên lượng rất tốt [26,39]. Gersony và cộng sự [26,35] đã cho thấy trên 85% bệnh nhân được điều trị nội khoa hoặc ngoại khoa ở trong tình trạng sức khoẻ rất tốt và sống một cách hữu ích. Chỉ 4,8% có phân độ chức năng NYHA III hoặc IV. Thêm vào đó, những nghiên cứu bệnh sử tự nhiên cho thấy rằng sống còn 25 năm sau phẫu thuật sửa chửa TLT là 89% [12,40]. Mặc dù có nhiều ca sống đến trên 70 tuổi, tỉ lệ sống còn sẽ kém đi nếu có tăng áp động mạch phổi [2,34,41]. Trong trường hợp có hội chứng Eisenmenger, tỉ lệ sống còn 25 năm là 41.7% so với 95.9% khi chỉ có TLT lỗ nhỏ. Những bệnh nhân có phức hợp Eisenmenger bị gia tăng nguy cơ viêm nội tâm mạc nhiễm trùng, hội chứng cô đặc máu, đột quỵ, suy thận, gout, suy tim, loạn nhịp nhĩ và loạn nhịp thất [1].
Đối với những bệnh nhân có sửa chửa TLT trước đó, những biến chứng muộn có thể có bao gồm:
- Khiếm khuyết dẫn truyền, thường gặp nhất là blốc nhánh phải kèm theo blốc phân nhánh trái trước đặc biệt là sau phẫu thuật xẻ thành tâm thất và đóng lỗ thông bằng miếng vá. Rối loạn chức năng nút xoang, kể cả blốc nhĩ thất cần phải đặt máy tạo nhịp thì ít gặp (≤2%) [36,42-44].
- Loạn nhịp nhanh, đặc biệt là khi có tăng áp động mạch phổi
- TLT tồn lưu bất kể phương pháp phẫu thuật nào, nhưng thường không ảnh hưởng đến huyết động và có dưới 10% bệnh nhân cần phẫu thuật lần 2 [7,12,36].
- Viêm nội tâm mạc nhiễm trùng, thường xảy ra khi có TLT tồn lưu hoặc hở van ĐMC.
- Rối loạn chức năng tồn lưu do tình trạng quá tải thể tích kéo dài, có thể bị làm nặng hơn bởi bệnh tim mạch mắc phải như tăng huyết áp và bệnh mạch vành.
- Hở van ĐMC tồn lưu (15-20%) cần phẫu thuật lại trong khoảng 5% trường hợp [45].
- Hở van 3 lá do biến dạng lá vách khi sửa chửa TLT.
- Tăng áp phổi tồn lưu làm xấu đi dự hậu lâu dài và có thể cần phải điều trị với thuốc dãn mạch, thuốc kháng thụ thể endothelin, hoặc thuốc đồng vận với prostacyclin.
KẾT LUẬN
TLT đơn thuần khác nhau về kích thước và vị trí và có thể có những biến chứng như hở van ĐMC, thất phải 2 buồng, tăng áp động mạch phổi, hoặc phình vách màng. Tất cả những biến chứng này có thể ảnh hưởng đến triệu chứng lâm sàng, thăm khám tim mạch cũng như huyết động của bệnh nhân. Do đó, việc thăm khám lâm sàng và siêu âm kỹ lưỡng rất quan trọng trong việc đánh giá bệnh nhân nhằm phòng ngừa việc tiến triển bệnh tắc nghẽn mạch máu phổi không hồi phục và bảo tồn tính toàn vẹn của van động mạch chủ và chức năng thât trái. Những hiểu biết sâu sắc về nội và ngoại khoa rất cần thiết cho việc điều trị tối ưu những bệnh nhân này. Những người lớn có bệnh TLT, thậm chí là những người có phức hợp Eisenmenger, khi được chăm sóc hợp lý, có thể sống một cuộc sống hữu ích.
KẾT QUẢ CỦA CA LÂM SÀNG
Người phụ nữ trẻ này đã biết bị TLT và bây giờ nhập viện vì khó thở, mệt, và đau ngực không điển hình, không có những dấu hiệu lâm sàng như tím tái, tăng áp động mạch phổi, suy tim hay hở van ĐMC. Điện tâm đồ và X quang phổi không có dấu hiệu lớn thất trái, lớn buồng tim phải hoặc dãn động mạch phổi. Siêu âm tim qua thành ngực cho thấy một lỗ TLT phần màng (Hình 4.2) nằm dưới van ĐMC có luồng thông trái phải khi siêu âm Doppler màu. Quan trọng nhất là thất trái dãn nhẹ với đường kính tâm trương bằng 54mm (bình thường 39-53mm), lớn nhĩ trái trung bình với thể tích bằng 37cc/m2 (bình thường <32), và áp lực tâm trương động mạch phổi bình thường bằng 8mmHg. Không có dấu hiệu các biến chứng như sa van ĐMC, hở van ĐMC, hoặc bằng chứng tắc nghẽn buồng tống thất phải. Sự hiện diện của lớn thất trái và lớn nhĩ trái là dấu hiệu quá tải thể tích của buồng tim trái mà không có tăng áp động mạch phổi. Thông tim được thực hiện để loại trừ khả năng bệnh mạch vành có thể là nguyên nhân gây lớn thất trái và để khẳng định độ nặng của luồng thông trái phải. Thông tim cho thấy một lỗ TLT phần màng kích thước trung bình với luồng thông trái phải, Qp/Qs = 1.74, thất trái dãn trung bình với thể tích cuối tâm trương là 196cc (112% so với bình thường), áp lực động mạch phổi bằng 27/5mmHg, động mạch vành bình thường.Chúng tôi khuyến cáo phẫu thuật sửa chữa dựa vào tình trạng triệu chứng cơ năng và dấu hiệu quá tải thể tích của buồng tim trái. Bệnh nhân đuợc phẫu thuật đóng lỗ thông liên thất qua đường mở xương ức. Quá trình hậu phẫu không biến chứng. Khi theo dõi tái khám, cô ta cho biết đã hết mệt mỏi và khó thở và không có âm thổi tồn lưu hay khiếm khuyết dẫn truyền trên điện tâm đồ. X quang ngực của bệnh nhân cho thấy có sự cải thiện kích thước tim với chỉ số tim lồng ngực giảm từ 54% còn 44% (hình 4.6).
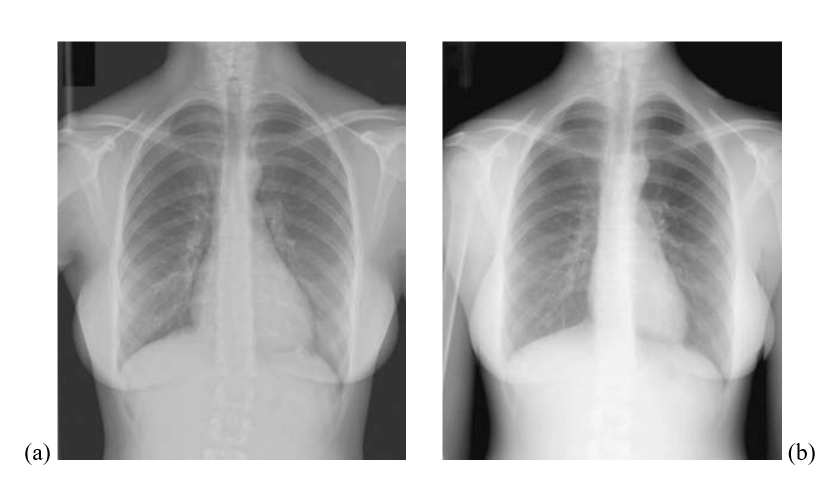
Hình 4.6 :X quang ngực trước (a) và sau (b) phẫu thuật đóng TLT, cho thấy giảm kích thước bóng tim.
Tài liệu tham khảo:S
- Ammash NM, Warnes CA. Ventricular septal defects in adults. Ann Intern Med 2001;135(9):812–24.
- Perloff JK, ed. Ventricular septal defect. In: The Clinical Recognition of Congenital Heart Disease (4th edition). Philadelphia:W.B. Saunders, 1994:396–439.
- Goor DA, LilleheiCW, Rees R, Edwards JE. Isolated ventricular septal defect.Development basis for various types and presentation of classification. Chest 1970;58(5):468–82.
- Shepherd RL, Glancy DL, Jaffe RB, Perloff JK, Epstein SE. Acquired subvalvular right ventricular outflow obstruction in patients with ventricular septal defect. Am J Med 1972;53(4):446–55.
- Momma K, Toyama K, Takao A, et al. Natural history of subarterial infundibular ventricular septal defect. Am Heart J 1984;108(5):1312–7.
- Tatsuno K, Konno S, Ando M, Sakakibara S. Pathogenetic mechanisms of prolapsing aortic valve and aortic regurgitation associated with ventricular septal defect. Anatomical, angiographic, and surgical considerations. Circulation 1973;48(5):1028– 37.
- Prasad S. Ventricular septal defect. In: Gatzoulis MA, Webb GD, Daubeney PEF, eds. Diagnosis and Management of Adult Congenital Heart Disease. Philadelphia: Churchill Livingstone, 2003:171–8.
- Battin M, Fong LV, Monro JL. Gerbode ventricular septal defect following endocarditis. Eur J Cardiothorac Surg 1991;5(11):613–4.
- Michel C, Rabinovitch MA, Huynh T. Gerbode’s defect associated with acute sinus node dysfunction as a complication of infective endocarditis. Heart 1996;76(4): 379.
- Neutze JM, Ishikawa T, Clarkson PM, et al. Assessment and follow-up of patients with ventricular septal defect and elevated pulmonary vascular resistance. Am J Cardiol 1989;63(5):327–31.
- Warnes CA, FusterV,DriscollDJ,McGoonDC. Congenital heart disease in adolescents and adults. C. Ventricular septal defect. In: Giuliani ER, Fuster V, Gersh BJ, McGoon MD, McGoon DC, eds. Cardiology: Fundamentals and Practice (2nd edition). St. Louis: Mosby-Year Book, 1991:1639–52.
- Kidd L, Driscoll DJ, Gersony WM, et al. Second natural history study of congenital heart defects. Results of treatment of patients with ventricular septal defects. Circulation 1993;87(2 Suppl):I38–51.apter 4 Ventricular septal defect 55
- Currie PJ, Seward JB, Chan KL, et al. Continuous wave Doppler determination of right ventricular pressure: a simultaneous Doppler-catheterization study in 127 patients. J Am Coll Cardiol 1985;6(4):750–6.
- Masuyama T, Kodama K, Kitabatake A, et al. Continuous-wave Doppler echocardiographic detection of pulmonary regurgitation and its application to noninvasive estimation of pulmonary artery pressure. Circulation 1986;74(3):484–92.
- Chan KL, Currie PJ, Seward JB, et al. Comparison of three Doppler ultrasound methods in the prediction of pulmonary artery pressure. J Am Coll Cardiol 1987;9(3):549–54.
- Nadas AS, Thilenius OG, Lafarge CG, Hauck AJ. Ventricular septal defect with aortic regurgitation: medical and pathologic aspects. Circulation 1964;29:862–73.
- Pieroni DR, Nishimura RA, Bierman FZ, et al. Second natural history study of congenital heart defects.Ventricular septal defect: echocardiography. Circulation 1993;87(2 Suppl):I80–8.
- Garg A, Shrivastava S, Radhakrishnan S, et al. Doppler assessment of interventricular pressure gradient across isolated ventricular septal defect. Clin Cardiol 1990;13(10): 717–21.
- Hagler DJ, Edwards WD, Seward JB, Tajik AJ. Standardized nomenclature of the ventricular septum and ventricular septal defects, with applications for two-dimensional echocardiography. Mayo Clin Proc 1985;60(11):741–52.
- Schmidt KG, Cassidy SC, Silverman NH, Stanger P. Doubly committed subarterial ventricular septal defects: echocardiographic features and surgical implications. J Am Coll Cardiol 1988;12(6):1538–46.
- Stauder NI, Miller S, Scheule AM, et al. MRI diagnosis of a previously undiagnosed large trabecular ventricular septal defect in an adult after multiple catheterizations and angiocardiograms. Br J Radiol 2001;74(879):280–2.
- Soto B, Coghlan CH, Bargerson LM. Angiography in ventricular septal defects. In: Anderson RH SE, ed. Paediatric Cardiology. Edinburgh: Churchill Livingstone, 1987: 125–35.
- Menahem S, Johns JA, del Torso S, et al. Evaluation of aortic valve prolapse in ventricular septal defect. Br Heart J 1986;56(3):242–9.
- Neumayer U, Stone S, Somerville J. Small ventricular septal defects in adults. Eur Heart J 1998;19(10):1573–82.
- Wilson W, Taubert KA, Gewitz M, et al. Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research InterdisciplinaryWorking Group. JAmDent Assoc 2007;138(6):739–45, 747–60.
- Gabriel HM, Heger M, Innerhofer P, et al. Long-term outcome of patients with ventricular septal defect considered not to require surgical closure during childhood. J Am Coll Cardiol 2002;39(6):1066–71.
- Vahanian A, Baumgartner H, Bax J, et al. Guidelines on the management of valvular heart disease: The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology. Eur Heart J 2007;28(2):230–68.
- Backer CL, Idriss FS, Zales VR, et al. Surgical management of the conal (supracristal) ventricular septal defect. J ThoracCardiovasc Surg 1991;102(2):288–95, discussion 295–6.
- Leung MP, Beerman LB, Siewers RD, et al. Long-term follow-up after aortic valvuloplasty and defect closure in ventricular septal defect with aortic regurgitation. Am J Cardiol 1987;60(10):890–4.
- Lun K, Li H, Leung MP, et al. Analysis of indications for surgical closure of subarterial ventricular septal defect without associated aortic cusp prolapse and aortic regurgitation. Am J Cardiol 2001;87(11):1266–70.
- Trusler GA, Moes CA, Kidd BS. Repair of ventricular septal defect with aortic insufficiency. Thorac Cardiovasc Surg 1973;66(3):394–403.
- Tweddell JS, Pelech AN, Frommelt PC. Ventricular septal defect and aortic valve regurgitation: pathophysiology and indications for surgery. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2006:147–52.
- Kostolny M, Schreiber C, von Arnim V, et al. Timing of repair in ventricular septal defect with aortic insufficiency. Thorac Cardiovasc Surg 2006;54(8):512–15.
- Ellis JHt, Moodie DS, Sterba R, Gill CC. Ventricular septal defect in the adult: natural and unnatural history. Am Heart J 1987;114(1 Pt 1):115–20.
- Gersony WM, Hayes CJ, Driscoll DJ, et al. Second natural history study of congenital heart defects. Quality of life of patients with aortic stenosis, pulmonary stenosis, or ventricular septal defect. Circulation 1993;87(2 Suppl):I52–65.
- Otterstad JE, Erikssen J, Froysaker T, Simonsen S. Long term results after operative treatment of isolated ventricular septal defect in adolescents and adults. Acta Med Scand Suppl 1986;708:1–39.
- Butera G, Carminati M, Chessa M, et al. Transcatheter closure of perimembranous ventricular septal defects: early and long-term results. J Am Coll Cardiol 2007;50(12): 1189–95.
- Hijazi ZM, Hakim F, Al-Fadley F, et al. Transcatheter closure of single muscular ventricular septal defects using the amplatzer muscular VSD occluder: initial results and technical considerations. Catheter Cardiovasc Interv 2000;49(2):167–72.
- Magee AG, Fenn L, Vellekoop J, Godman MJ. Left ventricular function in adolescents and adults with restrictive ventricular septal defect and moderate left-to-right shunting. Cardiol Young 2000;10(2):126–9.
- Weidman WH, Blount SG Jr, DuShane JW, et al. Clinical course in ventricular septal defect. Circulation 1977;56(1 Suppl):I56–69.
- Wood P. The Eisenmenger syndrome or pulmonary hypertension with reversed central shunt. Br Med J 1959:II701–9.
- Meijboom F, Szatmari A, Utens E, et al. Long-term follow-up after surgical closure of ventricular septal defect in infancy and childhood. J Am Coll Cardiol 1994;24(5): 1358–64.
- Tucker EM, Pyles LA, Bass JL, Moller JH. Permanent pacemaker for atrioventricular conduction block after operative repair of perimembranous ventricular septal defect. J Am Coll Cardiol 2007;50(12):1196–200.
- Andersen HO, de Leval MR, Tsang VT, et al. Is complete heart block after surgical closure of ventricular septum defects still an issue? Ann Thorac Surg 2006;82(3):948–56.
- Nygren A, Sunnegardh J, Berggren H. Preoperative evaluation and surgery in isolated ventricular septal defects: a 21 year perspective. Heart 2000;83(2):198–204. P2

Để lại bình luận
Bạn cần phải đăng nhập để đăng bình luận.