Judith Therrien
Người dịch: BS Huỳnh Thanh Kiều
Bệnh nhân nam 20 tuổi, được mổ sửa chữa hoàn toàn tứ chứng Fallot, vá thông liên thất và mở rộng đường thoát thất phải với miếng vá ngang vòng van lúc 1 tuổi. Giai đoạn hậu phẫu không có biến chứng, bệnh nhân được theo dõi định kỳ ở chuyên khoa tim mạch nhi, có hở van động mạch phổi và dãn thất phải. Bệnh nhân phát triển bình thường và không có triệu chứng cơ năng. Đến năm 18 tuổi, bệnh nhân được chuyển sang đơn vị chăm sóc của người lớn. Ở lần khám đầu tiên, bệnh nhân khai thỉnh thoảng có hồi hộp nhưng không choáng váng hay ngất, ngoài ra không triệu chứng gì khác. Khám thực thể và siêu âm tim thấy dãn thất phải và hở van động mạch phổi nặng. Kết quả chụp cộng hưởng từ (MRI) thấy dãn lớn thất phải với thể tích cuối tâm trương thất phải là 400 cc (235cc/m2) và chức năng tâm thu thất phải giảm. Holter điện tâm đồ phát hiện có rung nhĩ kịch phát với vài ngoại tâm thu thất.
Giới thiệu:
Tứ chứng Fallot là bệnh tim bẩm sinh tím thường gặp nhất sau 1 tuổi, tần suất khoảng 10% các bệnh tim bẩm sinh. Hiện nay hầu hết những trẻ mắc bệnh này đều được mổ sửa chữa hoàn toàn nên có tuổi thọ kéo dài và chất lượng cuộc sống tốt [1-3]. Tuy nhiên cần phải theo dõi cẩn thận vì những biến chứng muộn có thể xảy ra khi những đứa trẻ này trưởng thành.
Giải phẫu
Bất thường trong tứ chứng Fallot là sự di chuyển ra trước về phía đầu của vách phễu, tạo ra bốn sang thương sau: (1) tắc nghẽn đường thoát thất phải, có thể là hẹp phễu, hẹp van, hoặc cả hai, có kèm hoặc không hẹp trên van hay hẹp nhánh động mạch phổi; (2) thông liên thất không hạn chế; (3) động mạch chủ cưỡi ngựa (<50%); (4) và phì đại thất phải (hình 10.1). Gọi là ngũ chứng Fallot khi có thêm thông liên nhĩ. Những bất thường khác đi kèm gồm thông liên thất nhiều lỗ, bất thường động mạch vành, cung động mạch chủ bên phải, dãn gốc động mạch chủ, hở van động mạch chủ, tuần hoàn bàng hệ chủ phổi.
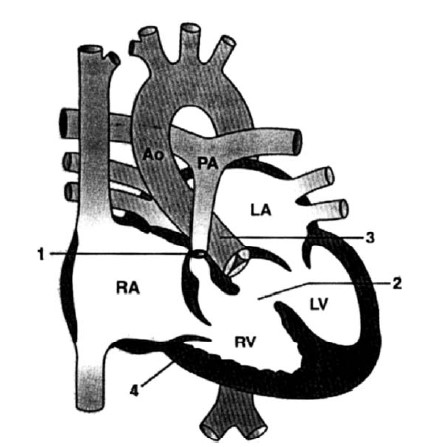
Hình 10.1: Sơ đồ tổn thương trong tứ chứng Fallot. (1) Hẹp phổi. (2) Thông liên thất. (3) Động mạch chủ cưỡi ngựa. (4) Phì đại thất phải. RA, nhĩ phải; RV, thất phải; LA, nhĩ trái; Ao, động mạch chủ; PA, động mạch phổi.
(From Mullins CE, Mayer DC. Congenital Heart Disease: A Diagrammatic Atlas. New York: Wiley-Liss, 1988; with permission.)
Phẫu thuật sửa chữa:
Hầu hết bệnh nhân người lớn đều được phẫu thuật tạm thời hoặc sửa chữa hoàn toàn trước đó. Hiếm khi còn bệnh nhân người lớn nào đến khám mà chưa từng được phẫu thuật trước đây.
Phẫu thuật sửa chữa hoàn toàn gồm vá thông liên thất và giải phóng tắc nghẽn đường thoát thất phải. Có thể là sửa van động mạch phổi, cắt bỏ bớt cơ vùng phễu hay đường thoát thất phải, miếng vá dưới vòng van (miếng vá ngang qua đường thoát thất phải bảo tồn vòng van động mạch phổi), hoặc miếng vá ngang vòng van (miếng vá đi ngang qua vòng van động mạch phổi) (hình 10.2). Một số hiếm có ống dẫn ngoài tim nối động mạch phổi và thất phải như ở bệnh nhân không lỗ van động mạch phổi, và có bất thường động mạch vành (động mạch vành trái xuất phát từ động mạch vành phải và đi ngang qua vùng phễu thất phải, chiếm 4% trường hợp). Ở thanh thiếu niên và người lớn được phẫu thuật sửa chữa muộn thường không dung nạp tốt với hở van động mạch phổi do đó có thể phải thay van động mạch phổi (van đồng loại hay van sinh học heo) trong lần mổ đầu tiên này. Tạo hình hoặc nới rộng động mạch phổi bị hẹp bằng miếng vá mở rộng ở bệnh nhân bị giảm sản thân động mạch phổi và/hoặc hẹp các nhánh động mạch phổi trung tâm. Sau cùng là vá thông liên nhĩ hay lỗ bầu dục nếu có.
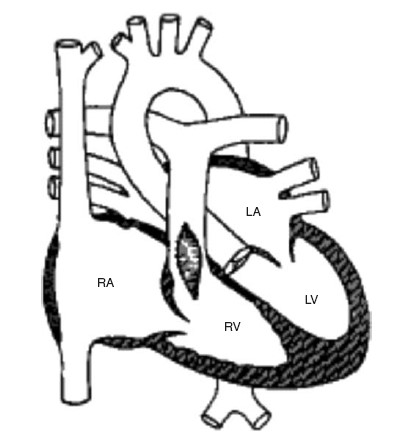
Hình 10.2: Sơ đồ phẫu thuật sửa chữa hoàn toàn tứ chứng Fallot. (1) Miếng vá thông liên thất. (2) Miếng vá (ngang vòng van) nới rộng thân động mạch phổi và đường thoát thất phải. RA, nhĩ phải; RV, thất phải; LA, nhĩ trái; Ao, động mạch chủ; PA, động mạch phổi.
(From Mullins CE, Mayer DC. Congenital Heart Disease: A Diagrammatic Atlas. New York: Wiley-Liss, 1988; with permission.)
Trước đây, người ta nghĩ rằng tắc nghẽn đường thoát thất phải nặng tồn lưu sau mổ là yếu tố dự hậu xấu. Vì thế mục tiêu chính của phẫu thuật viên là cố gắng làm giảm tắc nghẽn này. Các đường tiếp cận trong phẫu thuật sửa chữa tứ chứng Fallot đã cải tiến qua nhiều năm [4-8]. Trước đây những bệnh nhân được mổ qua đường thất phải, cần miếng vá lớn ngang vòng van để giải phóng hoàn toàn tắc nghẽn vùng phễu, thường gây hở van động mạch phổi. Gần đây người ta thấy về lâu dài đường rạch thất phải rộng và hở van động mạch phổi mãn tính ảnh hưởng xấu đến chức năng thất phải [9], có khuynh hướng gây rối loạn nhịp và đột tử trên lâm sàng [1.10]. Từ nhận xét này người ta có cải tiến trong phương pháp phẫu thuật sửa chữa tứ chứng Fallot, vá thông liên thất, giải phóng tắc nghẽn đường thoát thất phải kết hợp qua đường nhĩ phải và động mạch phổi [5,6]. Đường xẻ trên thất phải nhỏ thường cần miếng vá để nới rộng đường thoát thất phải và/ hoặc vòng van động mạch phổi. Người ta đã bỏ cách làm miếng vá ngang vòng van rộng và thường qui. Xu hướng hiện nay là cố gắng bảo tồn van động mạch phổi. Trước đây người ta nghĩ còn độ chênh lệch áp lực ngang đường thoát thất phải ngay sau mổ có ý nghĩa tiên lượng lâu dài xấu, nhưng độ chênh này thường giảm dần trong vòng vài ngày. Hơn nữa, với tắc nghẽn tồn lưu đơn độc mức độ nhẹ đến vừa bệnh nhân dung nạp rất tốt về sau. Hiện nay mục tiêu chính của phẫu thuật sửa chữa là tránh gây hở van động mạch phổi, dù không nặng và tránh để hẹp động mạch phổi tồn lưu.
Thời điểm phẫu thuật cũng thay đổi. Ngày nay bệnh nhân thường được mổ sớm khi có chẩn đoán hoặc khi có triệu chứng [4,5,8]. Điều trị sớm có lợi cho bệnh nhân vì bệnh nhân hết tím sớm, dòng máu lên động mạch phổi trở lại bình thường, thúc đẩy động mạch phổi phát triển.
Ở bệnh nhân Fallot lớn tuổi thường đã qua một hoặc vài lần phẫu thuật tạm trước khi được mổ sửa chữa hoàn toàn. Hiếm khi gặp bệnh nhân người lớn được phẫu thuật tạm chỉ với mục đích làm tăng lượng máu lên phổi. Những phẫu thuật tạm thời đó bao gồm shunt Blalock-Taussig cổ điển (nối động mạch dưới đòn với động mạch phổi phải), Waterston (nối động mạch chủ lên với động mạch phổi phải), hay Potts (nối động mạch chủ xuống với động mạch phổi trái). Tuy nhiên những shunt tạm thời này cũng có những biến chứng nghiêm trọng, như hẹp động mạch phổi khu trú, lượng máu lên phổi quá mức gây tăng áp động mạch phổi và dần dần đưa đến bệnh mạch máu phổi tắc nghẽn; quá tải thể tích thất trái. Ngày nay phần lớn người ta đã bỏ phẫu thuật làm shunt tạm vì sửa chữa hoàn toàn sớm được ưa chuộng hơn.
Biến chứng lâu dài sau phẫu thuật sửa chữa hoàn toàn:
Hở van động mạch phổi
Bệnh nhân sau mổ sửa chữa hoàn toàn tứ chứng Fallot, vá thông liên thất, sửa tắc nghẽn đường thoát thất phải, không hở van động mạch phổi nặng sau mổ, có tỉ lệ sống còn cao. Tỉ lệ sống sau 32 đến 36 năm lần lượt là 86% và 85% [2,12]. Hầu hết bệnh nhân người lớn đã mổ sửa chữa hoàn toàn trước đây có chất lượng cuộc sống tốt [1-3]. Trên 85% trường hợp theo dõi sau mổ không có triệu chứng cơ năng. Sau mổ sửa chữa hoàn toàn 20 năm, khoảng 10-15% bệnh nhân có triệu chứng, có thể gặp 2 tình huống sau: (1) hồi hộp do nhịp nhanh nhĩ và nhịp nhanh thất; (2) giảm khả năng gắng sức, thường do dãn thất phải thứ phát sau hở van động mạch phổi lâu ngày.
Hở phổi nặng thường gặp trong mổ sửa chữa có làm miếng vá ngang vòng van. Bệnh nhân hở van động mạch phổi mức độ nhẹ đến vừa thường dung nạp tốt. Nếu hở nặng có thể đưa đến triệu chứng của dãn và suy thất phải [9]. Nếu còn hẹp tồn lưu động mạch phổi đoạn gần hoặc xa, hay tăng áp phổi sẽ làm tăng độ nặng của hở van động mạch phổi và các tác động có hại lâu dài của hở phổi. Độ nặng của hở van động mạch phổi được đánh giá qua siêu âm Doppler xung, dòng trào ngược qua van động mạch phổi với dòng tâm trương ngắn (thời gian nửa áp lực < 100 ms) là dấu hiệu của hở phổi nặng [13] (hình 10.3). Bản đồ vận tốc dòng máu theo pha trên cộng hưởng từ đo được tỉ số dòng hở chính xác, là tiêu chuẩn vàng chẩn đoán hở phổi nặng [14]. Hở phổi nặng làm 1 lượng máu lớn trào ngược qua van động mạch phổi, làm dãn thất phải, nhưng đôi khi thất phải bình thường hoặc dãn nhẹ do cái gọi là “chức năng sinh lý hạn chế” của thất phải [15] (hình bên dưới).
Dãn thất phải
Dãn thất phải có thể thứ phát do tắc nghẽn đường thoát thất phải nặng tồn lưu [9] hoặc do hậu quả của sẹo mổ (sửa chữa qua đường thất). Hở van 3 lá nặng có thể là hậu quả của dãn thất phải, và nó tiếp tục làm thất phải dãn hơn nữa.
Thất phải hạn chế
Bảo vệ cơ tim không đầy đủ trong khi mổ, gây thiếu máu hoặc hoại tử cơ tim dẫn đến chức năng sinh lý của thất phải bị hạn chế sau mổ [16]. Mặc dù chức năng thất phải bị hạn chế có thể làm huyết động không ổn định trong giai đoạn chu phẫu, nhưng theo dõi lâu dài thấy nó có thể ngăn ngừa dãn thất phải tiến triển và tăng khả năng gắng sức ở bệnh nhân người lớn [15,17].
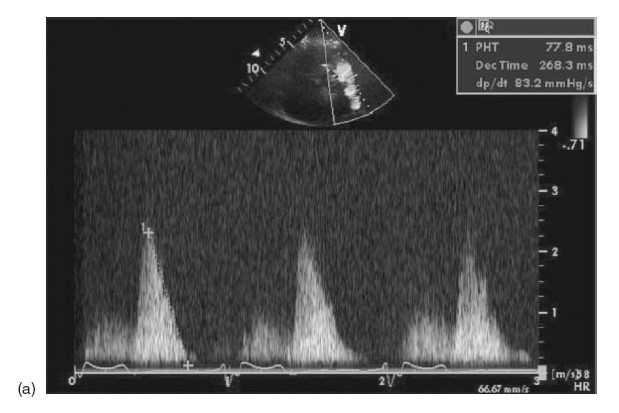
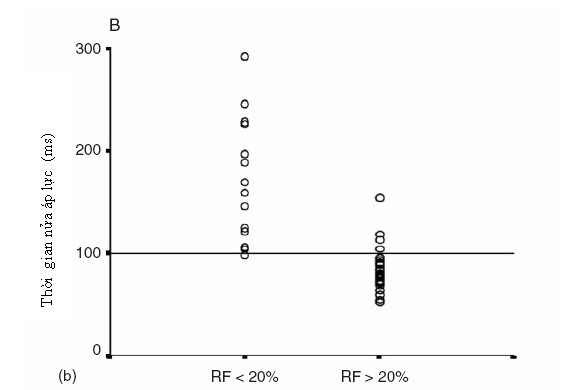
Hình 10.3 (a) Tín hiệu Doppler xung của dòng hở phổi trong thời kỳ tâm trương với thời gian nửa áp lực là 77.8 ms. (b) Mối tương quan giữa thời gian nửa áp lực đo trên siêu âm và tỉ số trào ngược đo trên MRI. PHT, thời gian nửa áp lực; RF, tỉ số trào ngược.
(From Silverside, et al. J Am Soc Echo 2003; 16:1057-62; with permission.)
Tắc nghẽn đường thoát thất phải tồn lưu
Tắc nghẽn đường thoát thất phải tồn lưu ở vùng phễu, tại van động mạch phổi, thân động mạch phổi chính và/ hoặc các nhánh lớn sau chổ chia đôi và có khi là các nhánh nhỏ của động mạch phổi phải và trái.
Phình dãn đường thoát thất phải
Thường gặp ở những bệnh nhân được mổ sửa chữa với miếng vá ngang vòng van bằng màng ngoài tim và hở phổi nặng. Chổ phình dãn này làm giảm vận động vùng của thất phải và có thể là ổ gây loạn nhịp nhanh thất kéo dài. Đến nay vẫn chưa có ghi nhận nào về tình trạng vỡ đột ngột của vùng phình dãn này.
Thông liên thất tồn lưu
Thông liên thất tồn lưu có thể gặp do một phần của miếng vá bị sút ra hoặc lúc mổ bít thông liên thất không hết, hoặc thông liên thất cơ bè không phát hiện được trước mổ.
Hở van động mạch chủ, có dãn hoặc không gốc động mạch chủ
Hở chủ có thể do van động mạch chủ bị tổn thương trong lúc mổ vá thông liên thất hoặc thứ phát do dãn gốc động mạch chủ (thường gặp hơn ở bệnh nhân không lỗ van động mạch phổi và có tuần hoàn bàng hệ chủ phổi). Chất nền bệnh lý của dãn gốc động mạch chủ có lẽ là hoại tử thành nang lớp trung mạc.
Rối loạn chức năng thất trái
Rối loạn chức năng thất trái có thể do các yếu tố sau như cơ tim không được bảo vệ tốt trong những lần mổ trước, quá tải thể tích thất trái do các shunt tạm thời để lâu ngày hoặc thông liên thất tồn lưu, tổn thương hay bất thường động mạch vành (ít gặp), hay tình trạng tím kéo dài trước khi phẫu thuật sửa chữa.
Ngoài ra, khi thất phải dãn quá lớn có thể đẩy vách liên thất về phía thất trái, làm thay đổi đổ đầy thất trái [15].
Rối loạn nhịp trên thất
Rung nhĩ và cuồng nhĩ thường gặp ở bệnh nhân người lớn sau mổ tứ chứng Fallot. Rối loạn nhịp nhanh ở nhĩ xảy ra trong 1/3 bệnh nhân người lớn, là bệnh thường gặp, kể cả tử vong ở giai đoạn muộn [19]. Rung nhĩ và cuồng nhĩ thường gặp hơn ở bệnh nhân có shunt động mạch chủ- động mạch phổi để lâu ngày (có tình trạng quá tải thể tích) và ở những bệnh nhân phải mổ lại sớm do các sang thương huyết động tồn lưu (những bệnh nhân có kết quả mổ lần đầu không được tối ưu). Phẫu thuật sửa chữa khi tuổi lớn hay hở van 3 lá mức độ vừa đến nặng là các yếu tố tiên đoán rung nhĩ hay cuồng nhĩ muộn [1]. Ngoài những dấu hiệu huyết động gợi ý ( dãn hay suy thất phải nặng, hở van 3 lá nặng), bản chất sinh loạn nhịp có thể là sẹo mổ trên tâm nhĩ, và yếu tố khởi phát là dãn nhĩ.
Ngoại tâm thu thất
Rối loạn nhịp thất không kéo dài trên Holter điện tim rất phổ biến (lên đến 60%) sau mổ tứ chứng Fallot. Ý nghĩa của ngoại tâm thu thất không rõ nhưng ngoại tâm thu độ ≥ II theo tiêu chuẩn Lown bổ sung (>30 ngoại tâm thu thất đơn dạng trong một giờ) có liên quan đến tăng nguy cơ đột tử.
Nhịp nhanh thất
Nhịp nhanh thất đơn dạng kéo dài tương đối ít gặp [1]. Cơ chế sinh lý bệnh thường gặp nhất là do vòng vào lại, và thường có nhiều yếu tố góp vào trong sinh bệnh học [21]. Yếu tố khởi phát rối loạn nhịp do vòng vào lại là dãn thất phải [22], sự căng, sợi hóa và hoạt hóa thất chậm [10], trong khi ở những vùng quanh miếng vá thông liên thất, đường thoát thất phải, và/ hoặc chổ xẻ thất phải là nơi thường phát sinh nhịp nhanh thất. Rối loạn thần kinh tự chủ, giảm biên độ dao động nhịp tim và độ nhạy cảm với phản xạ áp cảm thụ quan có gặp ở những bệnh nhân này, nhưng mức độ ảnh hưởng đến cơ chế của nhanh thất vẫn còn đang tìm hiểu [24].
Độ rộng của QRS trên điện tâm đồ bề mặt chuẩn có liên quan đến kích thước thất phải [10,25]. Phức bộ QRS lớn hơn hay bằng 180 ms là dấu hiệu chỉ điểm của nhịp nhanh thất kéo dài và đột tử trên bệnh nhân người lớn đã mổ sửa chữa tứ chứng Fallot [10] (hình 10.4 ). Phức bộ QRS kéo dài gợi ý: (1) tổn thương bó dẫn truyền trong lúc mổ sửa chữa tứ chứng Fallot [26] (xẻ thất phải, giải phóng hẹp cơ vùng dưới van động mạch phổi, may cố định miếng vá thông liên thất); và (2) dãn phức bộ QRS tiến triển thứ phát do dãn thất phải, hậu quả của hở van động mạch phổi mãn tính. Sự thay đổi độ rộng của QRS theo thời gian cũng là yếu tố tiên đoán nguy cơ của bệnh nhân [1].
Đột tử do tim
Tần suất đột tử ở giai đoạn muộn, có lẽ do rối loạn nhịp, trong hơn 30 năm theo dõi thay đổi từ 0.5% đến 6% , chiếm khoảng 1/3 đến 1/2 trường hợp tử vong muộn [2,3,27]. Nguy cơ đột tử tăng đáng kể sau 20 năm mổ tứ chứng Fallot (1.2% và 2.2% lúc 10 năm và 20 năm, tăng đến 4% lúc 25 năm và 6% lúc 35 năm) [1]. Phẫu thuật shunt tạm trước đó, mổ sửa chữa hoàn toàn khi lớn tuổi, tăng áp lực thất phải tương đối sau mổ (so với thất trái) là những yếu tố nguy cơ của đột tử muộn [2]. Miếng vá ngang vòng van, dẫn đến hở phổi và tốc độ dãn QRS tăng cũng là những yếu tố dự đoán đột tử [3]. Rối loạn chức năng thất trái làm tăng nguy cơ đột tử do tim [28].
Vấn đề tâm thần
Khoảng 15% bệnh nhân tứ chứng Fallot có khiếm khuyết nhiễm sắc thể 22q11 [29]. Tần suất khiếm khuyết nhiễm sắc thể 22q11 đặc biệt cao ở bệnh nhân có cung động mạch chủ bên phải, không lỗ van động mạch phổi, và tuần hoàn bàng hệ chủ phổi. Biểu hiện lâm sàng được tóm tắt trong hội chứng “CATCH 22’ (bất thường ở tim, bất thường ở mặt, giảm sản tuyến ức, chẽ vòm, hạ canxi máu [ sơ sinh], và khiếm khuyết nhiễm sắc thể 22q11). Bệnh nhân khiếm khuyết nhiễm sắc thể 22q11 có xu hướng rối loạn tâm thần muộn, thường nhất là trầm cảm. Tình trạng hiếu động quá mức và rối loạn khả năng tập trung chú ý thường gặp ở bệnh nhân trẻ. Những bệnh nhân này có 50% nguy cơ truyền bệnh cho con, vì thế cần phải tầm soát trong gia đình với FISH (Fluorescence in situ hybridization) và tư vấn về di truyền học.
Điều trị những biến chứng muộn sau phẫu thuật sửa chữa hoàn toàn
Hở van động mạch phổi nặng
Điều trị hẹp động mạch phổi ngoại biên bằng phẫu thuật hoặc thông tim có thể làm giảm độ nặng của hở van động mạch phổi [30]. Cần thay van động mạch phổi (van đồng loại hay van sinh học heo) trong trường hợp hở phổi nặng. Nguy cơ phẫu thuật thấp [12,31], cải thiện được triệu chứng cơ năng [32-34]. Tuy nhiên, thời điểm thích hợp để thay van động mạch phổi còn bàn cãi.
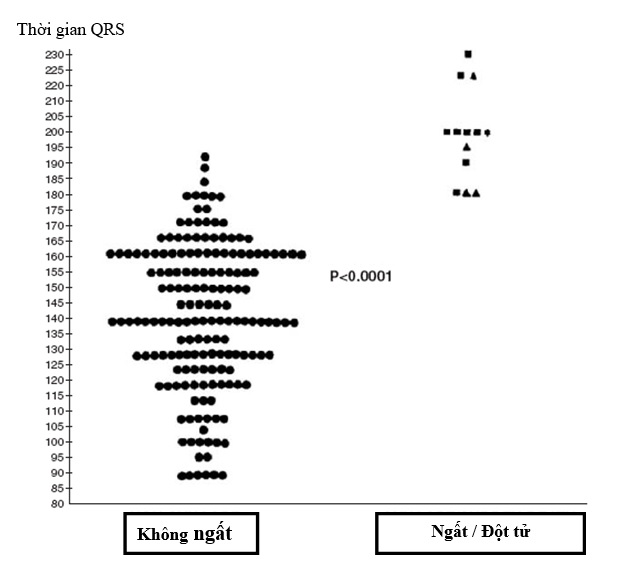
Hình 10.4: Biểu đồ thời gian phức bộ QRS tối đa ở 182 bệnh nhân được mổ sửa chữa hoàn toàn tứ chứng FAllot. Những bệnh nhân có ngất do nhịp nhanh thất đơn dạng kéo dài (9 bệnh nhân, hình vuông), cuồng nhĩ (1 bệnh nhân, hình sao) và đột tử do tim ( 4 bệnh nhân, hình tam giác) được biểu diễn riêng biệt ở cột bên phải.
(From Gatzoulis, và cộng sự. circulation 1995;92:231-7; with permission.)
Dãn thất phải
Khi thất phải dãn do hở phổi, thay van động mạch phổi đúng lúc, trước khi thất phải dãn và rối loạn chức năng không hồi phục là vấn đề mấu chốt [32]. Trong y văn có đề cặp đến tái cấu trúc thất phải sau thay van động mạch phổi không xảy ra hoàn toàn nếu thay van động mạch phổi khi thể tích cuối tâm trương thất phải (RVED volume) ≥ 170-180 cc/m2 [35,36]. Tuy nhiên, không có bằng chứng chứng minh phẫu thuật đúng thời điểm tái cấu trúc thất phải sẽ đem lại lợi ích sống còn cho những bệnh nhân này. Những kết quả lâm sàng xấu như tử vong hay nhịp nhanh thất thường gặp khi thể tích cuối tâm trương thất phải ≥ 170-180 cc/m2 [37]. Cần mổ tạo hình van 3 lá cùng lúc với mổ thay van động mạch phổi khi hở 3 lá mức độ trung bình trở lên.
Thất phải hạn chế
Nên sử dụng lợi tiểu trong giai đoạn hậu phẫu nếu chức năng sinh lý thất phải hạn chế gây tràn dịch màng phổi kéo dài. Duy trì nhịp xoang và đồng bộ nhĩ thất ở những bệnh nhân này là tối cần thiết, vì lưu lượng máu lên động mạch phổi và cung lượng tim phụ thuộc vào chức năng tâm thu của nhĩ phải.
Tắc nghẽn đường thoát thất phải tồn lưu.
Tắc nghẽn đường thoát thất phải tồn lưu đáng kể sau mổ có khi cần phải mổ lại (áp lực tâm thu thất phải ≥2/3 áp lực hệ thống) [38]. Phẫu thuật bao gồm cắt bỏ chổ hẹp vùng phễu tồn lưu hoặc đặt miếng vá ở đường thoát thất phải hay miếng vá ngang vòng van. Ngoài ra có thể nong đặt stent hoặc mổ sửa chữa hẹp các nhánh động mạch phổi. Nếu trước đây bệnh nhân đã thay ống có van động mạch phổi (<22 mm) nay bị hẹp lại, nên chọn phương pháp thay van động mạch phổi qua da vì kết quả huyết động tốt và tử vong tương tự như mổ [39], biến chứng ít hơn mổ thay van nhưng phải được thực hiện ở những trung tâm chuyên về bệnh tim bẩm sinh người lớn và có những chuyên gia về lĩnh vực này.
Phình dãn đường thoát thất phải
Mặc dù không có chỉ định rõ ràng, nhưng nếu phình dãn đường thoát thất phải nặng và tiến triển, có thể xem xét phẫu thuật cắt bỏ chổ phình.
Thông liên thất tồn lưu:
Nên cân nhắc việc mổ vá lại thông liên thất nếu lỗ thông có ảnh hưởng huyết động đáng kể như Qp/Qs ≥ 2/1 hay Qp/Qs = 1.5-2/1 kèm dãn hoặc suy chức năng thất trái [38] hoặc có tiền sử thuyên tắc nghịch thường.
Dãn gốc động mạch chủ
Phẫu thuật thay gốc van động mạch chủ được xét đến khi động mạch chủ lên ≥ 55 mm, đường kính gốc động mạch chủ gần đây tăng lên và/ hoặc có hở chủ nặng kèm theo [38]. Tuy nhiên, bóc tách hay vỡ động mạch chủ rất hiếm gặp.
Rối loạn chức năng thất trái
Không có dữ liệu về phương pháp điều trị suy chức năng thất trái trên những bệnh nhân này. Suy diễn từ cơ sở điều trị rối loạn chức năng thất trái do bệnh cơ tim hay do thiếu máu cục bộ thì các thuốc ức chế men chuyển, digoxin, ức chế bêta và lợi tiểu có thể có lợi. Nên làm thêm những khảo sát để loại trừ bệnh mạch vành đi kèm hay luồng thông tồn lưu.
Rối loạn nhịp trên thất
Đánh giá kỹ những tổn thương tồn lưu có ảnh hưởng huyết động của bệnh nhân có rung nhĩ và/ hoặc cuồng nhĩ kéo dài, đặt ra mục tiêu sửa chữa những tổn thương này (vd, hở phổi gây dãn thất phải nặng, hậu quả là hở van 3 lá nặng, cần phẫu thuật thay van động mạch phổi và tạo hình vòng van 3 lá). Ngày nay cắt đốt bằng sóng radio sau khi dò được bản đồ vào lại ở nhĩ, đem lại kết quả tốt hơn trong điều trị cuồng nhĩ cổ điển và/ hoặc nhịp nhanh do vòng vào lại có thể cắt đốt được, nên thực hiện qua đường thông tim (nếu bệnh nhân không cần mổ lại) hoặc trong lúc phẫu thuật sửa chữa những tổn thương khác [40]. Đối với rung nhĩ nên cân nhắc làm phẫu thuật Maze ở nhĩ phải hoặc 2 nhĩ, lý tưởng nên thực hiện cùng lúc mổ lại những tổn thương khác. Ngoài ra có thể sử dụng thuốc chống loạn nhịp và máy tạo nhịp chống nhịp nhanh nhĩ thế hệ mới hỗ trợ thêm.
Ngoại tâm thu thất
Hiện tại không có bằng chứng có lợi khi điều trị dự phòng rối loạn nhịp cho những bệnh nhân rối loạn nhịp thất không triệu chứng được ghi nhận trên Holter.
Nhịp nhanh thất
Những bất thường về huyết động trên tim phải, chủ yếu dãn lớn thất phải do hở phổi, có hoặc không có kèm với hẹp phổi, rất thường gặp ở những bệnh nhân có nhịp nhanh thất kéo dài [1,11]. Vì thế, khám tỉ mỉ để phát hiện được những bất thường này rất quan trọng. Can thiệp sửa chữa những tổn thương cơ bản còn tồn lưu, thường bên tim phải, rất cần thiết để giảm nguy cơ và điều trị rối loạn nhịp trên những bệnh nhân này. Thông tim (nếu không cần mổ lại) hoặc phẫu thuật cắt đường dẫn truyền của nhịp nhanh thất nên thực hiện trong lúc mổ sửa những tổn thương khác [33]. Vai trò của máy chuyển nhịp phá rung cấy được (AICD) ở những bệnh nhân này chưa rõ ràng, tuy nhiên có thể là phương pháp điều trị hỗ trợ thêm sau cắt đốt nhịp nhanh thất vì nguy cơ nhanh thất tái phát sau cắt đốt thay đổi từ 0% đến 30% [11,39,41] hoặc khi không thể cắt đốt được nhịp nhanh thất.
Đột tử do tim
Bệnh nhân đột tử do tim được cứu sống nên phẫu thuật sửa chữa những tổn thương huyết động đáng kể còn tồn lưu, phối hợp với cắt đốt nhịp nhanh thất. Đặt máy chuyển nhịp phá rung cấy được (AICD) để phòng ngừa thứ phát nhịp nhanh thất kéo dài và đột tử do tim, ngay cả sau khi đã mổ sửa chữa những sang thương tồn lưu và cắt đốt nhịp nhanh thất [11,39,41,42].
Ngăn ngừa những biến chứng muộn sau phẫu thuật sửa chữa hoàn toàn
Hở van động mạch phổi nặng
Những thay đổi trong kỹ thuật mổ gần đây [5,6], hạn chế cắt bỏ quá mức để giải phóng hẹp đường thoát thất phải, tránh miếng vá ngang vòng van hy vọng sẽ giảm bớt mức độ hở van động mạch phổi.
Dãn thất phải
Với kỹ thuật mổ mới tiếp cận qua đường nhĩ [5] (thay vì qua đường thất như trước đây) sẽ làm giảm mức độ tổn thương thất phải [43,44]. Những thay đổi trong kỹ thuật mổ gần đây hạn chế giải phóng quá mức hẹp đường thoát thất phải, tránh miếng vá ngang vòng van [5,6] và không làm hở van động mạch phổi hy vọng sẽ làm giảm mức độ dãn và suy chức năng thất phải theo thời gian.
Thất phải hạn chế
Cải thiện phương pháp bảo vệ cơ trong lúc mổ có thể làm giảm mức độ thiếu máu cục bộ cơ tim của thất phải và thay đổi tỉ lệ chức năng sinh lý thất phải hạn chế sau mổ.
Phình dãn đường thoát thất phải
Giảm tối thiểu mức độ xẻ đường thoát thất phải và kích thước của miếng vá tạo hình nhân tạo ở đường thoát thất phải có thể sẽ giảm tần suất phình dãn đường thoát thất phải.
Rối loạn chức năng thất trái
Tiến đến mổ sửa chữa hoàn toàn ở giai đoạn sớm [4,5,8], tránh để tình trạng tím kéo dài, hạn chế mổ làm shunt tạm và bảo vệ cơ tim đầy đủ trong lúc mổ có thể giảm đáng kể tình trạng rối loạn chức năng thất trái sau mổ. Điều chỉnh các yếu tố nguy cơ bệnh mạch vành sớm cũng góp phần làm giảm tiến triển suy thất trái về sau.
Viêm nội tâm mạc
Bệnh nhân có tiền sử viêm nội tâm mạc, có van nhân tạo, luồng thông tồn lưu, còn tím sau mổ, hoặc trong 6 tháng đầu sau mổ bắt buộc phòng ngừa viêm nội tâm mạc nhiễm trùng.
Rối loạn nhịp trên thất
Phương pháp phẫu thuật giảm thiểu tối đa sẹo mổ ở nhĩ, tránh để tồn lưu những tổn thương gây dãn nhĩ phải có thể làm giảm tần cuồng nhĩ và rung nhĩ
ở những bệnh nhân này.
Nhịp nhanh thất kéo dài
Phương pháp phẫu thuật giảm thiểu tối đa sẹo mổ ở thất, tránh để những sang thương tồn lưu gây dãn thất phải có thể làm giảm tần suất nhịp nhanh thất [5,43,44]. Vai trò của khảo sát điện sinh lý trên những bệnh nhân dãn thất phải không có triệu chứng còn bàn cãi, tuy nhiên trên những bệnh nhân “nguy cơ cao” (tiền sử hồi hộp hoặc ngất, mổ sửa chữa hoàn toàn khi lớn tuổi, có miếng vá ngang vòng van, QRS > 180 ms, Lown bổ sung ≥ II, v.v) có thể có lợi khi gây ra được nhịp nhanh thất hay rung thất vì có giá trị tiên đoán rối nhịp thất trong tương lai [46].
Đột tử do tim
Phòng ngừa tiên phát đột tử bằng máy chuyển nhịp phá rung cấy được (AICD) cho những bệnh nhân nguy cơ cao (có mổ shunt tạm trước đây, QRS > 180 ms, tạo được nhịp nhanh thất khi khảo sát điện sinh lý, rối loạn chức năng thất trái) có thể có lợi [42] (Hình 10.5) và có lẽ tốt nhất nên đặt dự phòng cho những bệnh nhân có nguy cơ đột tử hằng năm cao ( ≥ 3.5% mỗi năm) [47].
Ca lâm sàng
Bệnh nhân này có thất phải dãn rất lớn kèm rung nhĩ kịch phát trên nền hở van động mạch phổi nặng. Trắc nghiệm gắng sức cho thấy hạn chế hoạt động thể lực mặc dù bệnh nhân khai không có triệu chứng cơ năng. Dựa trên những bằng chứng này, bệnh nhân được chỉ định thay van động mạch phổi đồng thời làm phẫu thuật Maze nhĩ trái và nhĩ phải trong lúc mổ thay van. Kích thước thất phải có cải thiện sau mổ tuy nhiên vẫn còn dãn mức độ trung bình.
Tóm tắt
Tiên lượng sống còn lâu dài ở bệnh nhân người lớn đã được mổ sửa chữa hoàn toàn tứ chứng Fallot rất tốt, hầu hết bệnh nhân có cuộc sống như bình thường và không có triệu chứng. Những vấn đề thường gặp của đường thoát thất phải như hở phổi nặng, tắc nghẽn vùng phễu tồn lưu đưa đến dãn dần và suy chức năng thất phải, hậu quả là loạn nhịp thất và trên thất. Nên tìm và sửa chữa những bất thường về mặt huyết động gây ra rối loạn nhịp nhanh này (dãn và rối loạn chức năng thất phải, hở phổi nặng) và phối hợp các phương pháp điều trị trực tiếp rối loạn nhịp (thuốc chống loạn nhịp, cắt đốt lạnh, hay đặt máy chuyển nhịp phá rung cấy được). Với những cải tiến gần đây trong cách tiếp cận sửa chữa tứ chứng Fallot hy vọng sẽ giảm bớt tần suất biến chứng muộn trong tương lai.
|
Thông số Exp(ß) Điểm số
Có mổ shunt tạm trước đây 3.2 2 Gây ra được nhịp nhanh thất kéo dài 2.6 2 Thời gian QRS ≥ 180 ms 1.4 1 Rạch qua tâm thất 3.4 2 Nhịp nhanh thất không kéo dài 3.7 2 LVEDP ≥ 12 mmHg 4.9 3 Tổng cộng … 0-12 |
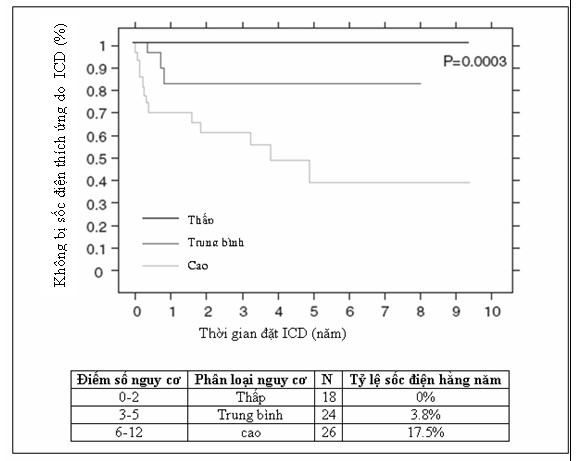
Hình 10.5 (a) Điểm số nguy cơ từ những cú sốc điện của máy phá rung trong phòng ngừa tiên phát. (b) Đường cong sống còn của Kaplan-Meier không phụ thuộc vào những cú sốc điện phù hợp của máy phá rung trong phòng ngừa tiên phát và so sánh với phân loại điểm số nguy cơ. ICD, máy chuyển nhịp phá rung cấy được
(From Khairy, và CS. Circulation 2008; 117:363-70; with permission.)
Tài liệu tham khảo:
- Gatzoulis MA, Balaji S, Webber SA, et al. Risk factors for arrhythmia and sudden death in repaired tetralogy of Fallot: a multi-centre study. Lancet 2000;356:975–81.
- Murphy JG, Gersh BJ, Mair DD, et al. Long-term outcome in patients undergoing surgical repair of tetralogy of Fallot. N Engl J Med 1993;329:593–9.
- Nollert G, Fischlein T, Bouterwek S, et al. Long-term survival in patients with repair of tetralogy of Fallot: 36-year follow-up of 490 survivors of the first year after surgical repair. J Am Coll Cardiol 1997;30:1374–83.
- DiDonato RM, Jonas RA, Lang P, et al. Neonatal repair of tetralogy of Fallot with and without pulmonary atresia. J Thorac Cardiovasc Surg 1991;101:126–37.
- Karl TR, Porniviliwan S, Mee RBB. Tetralogy of Fallot: favourable outcome of nonneonatal transatrial, transpulmonary repair. Ann Thorac Surg 1992;54:903–7.
- Kawashima Y, Kitamura S, Nakano S, et al. Corrective surgery for tetralogy of Fallot without or with minimal right ventriculotomy and with repair of the pulmonary valve. Circulation 1981;64:147–53.
- LilleheiCW, Cohen M,Warden HE, et al. Direct vision intracardiac surgical correction of the tetralogy of Fallot, pentalogy of Fallot, and pulmonary atresia defects; report of first ten cases. Ann Surg 1955;142:418–45.
- Reddy VM, Liddicoat JR, McElhinney DB, et al. Routine repair of tetralogy of Fallot in neonates and infants less than three months of age. Ann Thorac Surg 1995;60: S592–6.
- Redington AN, Oldershaw PJ, Shinebourne EA, Rigby ML. A new technique for the assessment of pulmonary regurgitation and its application to the assessment of right ventricular function before and after repair of tetralogy of Fallot. Br Heart J 1988;60: 57–65.
- Gatzoulis MA, Till JA, Somerville J, Redington AN. Mechanoelectrical interaction in tetralogy of Fallot. QRS prolongation relates to right ventricular size and predicts malignant ventricular arrhythmias and sudden death [see comments]. Circulation 1995;92:231–7.
- HarrisonDA, Harris L, Siu SC, et al. Sustained ventricular tachycardia in adult patients late after repair of tetralogy of Fallot. J Am Coll Cardiol 1997;30:1368–73.nital Heart Disease
- Oechslin EN, Harrison DA, Harris L, et al. Reoperation in adults with repair of tetralogy of Fallot: Indications and outcomes. J Thorac Cardiovasc Surg 1999;118: 245–51.
- Silversides C, Veldtman G, Crossin J, et al. Pressure half time correlates with severity of pulmonary regurgitation in adults with repaired tetralogy of Fallot. J Am Soc Echocardiogr 2003;16:1057–62.
- Rebergen SA, Chin JG, Ottenkamp J, van derWall EE, de Roos A. Pulmonary regurgitation in the late postoperative follow-up of tetralogy of Fallot. Volumetric quantitation by nuclear magnetic resonance velocity mapping. Circulation 1993;88:2257–66.
- Helbing WA, Niezen RA, LeCessie S, et al. Right ventricular diastolic function in children with pulmonary regurgitation after repair of tetralogy of Fallot: volumetric evaluation by magnetic resonance mapping. J Am Coll Cardiol 1996;28:1827–35.
- Chatuverdi RR, Shore DF, Lincoln C, et al. Acute right ventricular restrictive physiology after repair of tetralogy of Fallot: association with myocardial injury and oxidative stress. Circulation 1999;100:1540–7.
- Gatzoulis MA, Clark AL, Cullen S, et al. Right ventricular diastolic function 15 to 35 years after repair of tetralogy of Fallot: restrictive physiology predicts superior exercise performance. Circulation 1995;91:1775–81.
- Niwa K, Perloff JK, Bhuta SM, et al. Structural abnormalities of the great arterial walls in congenital heart disease: light and electron microscopic analyses. Circulation 2001;103:393–400.
- Roos-Hesselink J, Perlroth MG, McGhie J, et al. Atrial arrhythmias in adults after repair of tetralogy of Fallot. Correlations with clinical, exercise, and echocardiographic findings. Circulation 1995;91:2214–9
- Cullen S, Celermajer DS, Franklin RC, et al. Prognostic significance of ventricular arrhythmia after repair of tetralogy of Fallot: a 12-year prospective study. J Am Coll Cardiol 1994;23:1151–5.
- Kugler JD, Pinsky WW, Cheatham JP, et al. Sustained ventricular tachycardia after repair of Fallot: new electrophysiological findings. Am J Cardiol 1983;51:1137–43.
- Marie P-Y, Marcon F, Brunotte F, et al. Right ventricular overload and induced sustained ventricular tachycardia in operatively “repaired” tetralogy of Fallot.AmJCardiol 1992;69:785–9.
- Babu-Narayan SV, Kilner PJ, LiW, et al. Ventricular fibrosis suggested by cardiovascular magnetic resonance in adults with repaired tetralogy of Falot and its relationship to adverse markers of clinical outcome. Circulation 2006;113:405–13.
- Davos CH, Davlouros PA, Wensel R, et al. Global impairment of cardiac autonomic nervous activity late after repair of tetralogy of Fallot. Circulation 2002;106:I-69–75.
- Abd El Rahman HY, Abul-Khaliq H, Vogel M, et al. Relation between right ventricular enlargement, QRS duration, and right ventricular function in patients with tetralogy of Fallot and pulmonary regurgitation after surgical repair. Heart 2000;84:416–20.
- Norgard G, Gatzoulis M, Moraes F, et al. The relationship between type of outflow tract repair and postoperative right ventricular diastolic physiology in tetralogy of Fallot: implications for long-term outcome. Circulation 1996;94:3276–81.
- Silka MJ, Hardy BG, Menashe VD, Morris CD. A population-based prospective evaluation of risk of sudden cardiac death after operation for common congenital heart defects. J Am Coll Cardiol 1998;32:245–51.of Fallot 155
- Ghai A, Silversides C, Harris L, et al. Left ventricular dysfunction is a risk factor for sudden cardiac death in adults late after repair of tetralogy of Fallot. J Am Coll Cardiol 2002;40:1675–80.
- Goldmuntz E, Clark BJ, Mitchell LE, et al. Frequency of 22q11 deletions in patients with conotruncal defects. J Am Coll Cardiol 1998;32:492–8.
- Chaturvedi RR, Kilner P, White P, et al. Increased airway pressure and simulated branch pulmonary stenosis increase pulmonary regurgitation after repair of tetralogy of Fallot: real-time analysis using conductance catheter technique. Circulation 1997;95:643–9.
- Yemets IM, Williams WG, Webb GD, et al. Pulmonary valve replacement late after repair of tetralogy of Fallot. Ann Thorac Surg 1997;64:526–30.
- Therrien J, Siu S, Liu P, et al. Pulmonary valve replacement in adults late after repair of tetralogy of Fallot: are we operating too late? J Am Coll Cardiol 2000;36: 1670–5.
- Warner KG, Anderson JE, FultonDR, et al. Restoration of the pulmonary valve reduces right ventricular volume overload after previous repair of tetralogy of Fallot. Circulation 1993;88:II-189–97.
- Vliegen HW, van Straten A, de Roos A, et al. Magnetic resonance imaging to assess the hemodynamic effects of pulmonary valve replacement in adults late after repair of tetralogy of Fallot. Circulation 2002;106:1703–7.
- Therrien J, Provost Y, Merchant N, et al. Optimal timing for pulmonary valve replacement in adults after tetralogy of Fallot repair. Am J Cardiol 2005;95:779–82.
- Oosterhof T, van Straten A, VliegenHW, et al. Preoperative thresholds for pulmonary valve replacement in patients with corrected tetralogy of Fallot using cardiovascular magnetic resonance. Circulation 2007;116:545–51.
- Knauth AL, Gauvreau K, Powell AJ, et al. Ventricular size and function assessed by cardiac MRI predict major adverse clinical outcomes late after tetralogy of Fallot repair. Heart 2008;94:211–16.
- Therrien J, Dore A, GersonyW, et al. Canadian Cardiovascular Society. CCS Consensus Conference 2001 update: recommendations for the management of adults with congenital heart disease. Part I. Can J Cardiol 2001;17:940–59.
- Khambadkone S, Coats L, Taylor A, et al. Percutaneous pulmonary valve implantation in humans: results in 59 consecutive patients. Circulation 2005;112:1189–97.
- Karamlout T, Sibler I, Lao R, et al. Outcomes after late reoperation in patients with repaired tetralogy of Fallot: the impact of arrhythmia and arrhythmia surgery. Ann Thorac Surg 2006;81:1786–93.
- Therrien J, Siu S, Harris L, et al. Impact of pulmonary valve replacement on arrhythmia propensity late after repair of tetralogy of Fallot. Circulation 2001;103:2489–94.
- Khairy P, Harris L, Landzberg MJ, et al. Implantable cardiac defibrillators in tetralogy of Fallot. Circulation 2008;117:363–70.
- Dietl CA, Cazzaniga ME, Dubner SJ, et al. Life-threatening arrhythmias and RV dysfunction after surgical repair of tetralogy of Fallot: comparison between transventricular and transatrial approaches. Circulation 1994;90(part 2):II-7–12.
- Kawashima Y, Matsuda H, Hirose H, et al. Ninety consecutive corrective operations for tetralogy of Fallot with or without minimal right ventriculotomy. J Thorac Cardiovasc Surg 1985;90:856–63.l Heart Disease
- Wilson W, Taubert DA, Gewitz M, et al. Prevention of infective endocarditis. AHA Guideline. Circulation 2007;116:1736–54.
- Khairy P, Landzberg MJU, Gatzoulis MA, et al. Prognostic significance of electrophysiology testing post tetralogy of Fallot repair: a multicenter study. Circulation 2004;109:1994–2000.
- Khairy P. Programmed ventricular stimulation for risk stratification in patients with tetralogy of Fallot: a Bayesian perspective. Nat Clin Pract 2007;6:292–3.

Để lại bình luận
Bạn cần phải đăng nhập để đăng bình luận.