Candice K.Silversides and Samuel C.Siu
Người dịch: BS. Vũ Năng Phúc/ BS. Đinh Đức Huy
Bệnh nhân nam 35 tuổi, tiền căn phẫu thuật sửa chữa Tứ chứng Fallot, nhập viện với triệu chứng hồi hộp và ngất. Bệnh nhân được phẫu thuật lần đầu tạo luồng thông Blalock-Taussig lúc 2 tháng tuổi. Sau đó,bệnh nhân được phẫu thuật tim hở lúc 8 tuổi với miếng vá từ buồng tống thất phải ngang vòng van. bệnh nhân bị hở van động mạch phổi tồn lưu nhưng lâm sàng ổn định cho tới lúc nhập viện. Khám lâm sàng, bệnh nhân có lớn thất phải và âm thổi hở van động mạch phổi nhưng không có dấu hiệu suy tim phải. Điện tâm đồ ghi nhận nhịp xoang với blốc nhánh phải (QRS kéo dài 180ms). bệnh nhân được nhập viện để theo dõi và cơn 30 nhịp nhanh thất không kéo dài ghi nhận trong telemetry. Xét nghiệm hình ảnh học nào nên được thực hiện?
Do tính chất phức tạp của bệnh tim bẩm sinh, hình ảnh học tim mạch có vai trò rất quan trọng trong theo dõi điều trị bệnh nhân. Mỗi phương pháp hình ảnh học đều cũng có những ưu điểm và giới hạn. Do đó, BS điều trị cho bệnh nhân BTBS cần hiểu thật rõ những điểm này. Những hướng dẫn lâm sàng hiện hành về theo dõi bệnh nhân BTBS đều có khuyến cáo cho việc áp dụng các phương pháp hình ảnh học khác nhau [1-4]. Hơn nữa, những hướng dẫn sử dụng và chỉ định áp dụng cho bệnh tim bẩm sinh của chụp cắt lớp tim [5], cộng hưởng từ tim [6], và xạ hình tim đã được công bố [7,8,9]. Hiện tại, không có một phương pháp hình ảnh học đơn độc nào có thể cung cấp tất cả thông tin cần thiết để theo dõi bệnh nhân, và thông thường mỗi bệnh nhân được thực hiện nhiều chẩn đoán hình ảnh học khác nhau. Các phương pháp hình ảnh học và ưu nhược điểm của từng phương pháp sẽ được bàn bạc riêng trong từng tổn thương bẩm sinh.
Bảng 13.1: Chỉ định của Cộng hưởng từ tim (CMR) trong bệnh lý tim bẩm sinh [6]
|
|
Loại |
|
I. Chỉ định tổng quát: |
|
|
Đánh giá ban đầu và theo dõi BTBS người lớn |
I |
|
II. Các Chỉ định đặc trưng: |
|
|
Đánh giá độ nặng luồng thông (Qp/Qs) |
I |
|
Bất thường vị trí giữa nội tạng và nhĩ |
|
|
Bất thường đơn độc |
II |
|
Vị trí bất thường kèm BTBS phức tạp |
I |
|
Bất thường của nhĩ và hồi lưu tĩnh mạch |
|
|
Thông liên nhĩ |
II |
|
Hồi lưu bất thường TM phổi đặc biệt trong trường hợp bất thường phức tạp và tim 3 buồng nhĩ |
I |
|
Hồi lưu bất thường TM hệ thống |
|
|
Tắc nghẽn TM hệ thống hoặc TM phổi sau phẫu thuật sửa chữa vách ngăn nhĩ hoặc sửa chữa hồi lưu bất thường TM phổi |
I |
|
Bất thường van nhĩ thất |
|
|
Bất thường giải phẫu van 2 lá và van 3 lá |
II |
|
Bất thường chức năng van |
II |
|
Bệnh Ebstein |
II |
|
Kênh nhĩ thất |
II |
|
Bất thường buồng thất |
|
|
Thông liên thất đơn độc |
III |
|
Thông liên thất phối hợp các bất thường phức tạp |
I |
|
Túi phình – túi thừa thất |
II |
|
Thông liên thất phần phễu |
I |
|
Lượng giá thể tích, khối lượng, chức năng của thất trái – phải |
I |
|
Bất thường van bán nguyệt |
|
|
Hẹp hoặc loạn sản van động mạch phổi đơn độc |
III |
|
Hẹp động mạch phổi trên thất |
II |
|
Hở phổi |
I |
|
Hẹp van động mạch chủ đơn độc |
III |
|
Hẹp dưới động mạch chủ |
III |
|
Hẹp trên van động mạch chủ |
I |
|
Bất thường động mạch |
|
|
Bất thường vị trí đại động mạch |
II |
|
Theo dõi luồng thông (shunt) sau mổ |
I |
|
Phình động mạch chủ (xoang Valsalva) |
I |
|
Hẹp eo động mạch chủ |
I |
|
Vòng nhẫn mạch máu |
I |
|
Còn ống động mạch |
III |
|
Cửa sổ phế chủ |
I |
|
Bất thường mạch vành ở trẻ nhỏ |
NC |
|
Bất thường lỗ xuất phát mạch vành ở người lớn và trẻ em |
I |
|
Không lỗ van động mạch phổi |
I |
|
Hẹp động mạch phổi chính |
I |
|
Hẹp động mạch phổi ngoại biên |
NC |
|
Tuần hoàn bàng hệ chủ-phổi |
I |
|
NC: còn nghiên cứu |
|
Các phương pháp hình ảnh học
Siêu âm tim qua thành ngực là một trong những phương pháp hình ảnh học cơ bản trong lĩnh vực tim bẩm sinh bởi vì trang thiết bị có thể di động và thực hiện dễ dàng. Siêu âm tim giúp xác định giải phẫu tim và bệnh học van tim. Hình ảnh Doppler màu cho phép thấy được thông liên thất và thông liên nhĩ lỗ nhỏ, thường rất khó quan sát nếu sử dụng các kỹ thuật khác. Doppler có nhiều ưu điểm cho phép đo không xâm nhập chênh áp giữa các buồng tim và đánh giá chức năng tâm trương của tim. Trong nhiều trường hợp, siêu âm có thể đánh giá chính xác chức năng tâm thu thất trái, tuy nhiên đánh giá kích thước và chức năng tâm thu thất phải rất khó khăn. Mặc dù có thể dùng siêu âm tim để đo sự di động kỳ tâm thu của vòng van 3 lá [10,11], tốc độ vận động vòng van 3 lá kỳ tâm thu [12], chỉ số tưới máu cơ tim [13-16], thời gian gia tốc đồng thể tích; nhưng hiện nay hình ảnh cộng hưởng từ là tiêu chuẩn cho phép định lượng cấu trúc và chức năng thất phải. Những kỹ thuật siêu âm tim mới tiếp tục được cải tiến và cho phép đánh giá các thông số như chức năng từng vùng thất hoặc sức căng, xoắn, đồng bộ và tưới máu. Tuy nhiên, SAT qua thành ngực có thể hạn chế ở người lớn với cửa sổ siêu âm kém do thành ngực dày, biến dạng thành ngực, hay do mô sẹo sau mổ. Những tiến bộ trong siêu âm tim 3 chiều hứa hẹn sẽ trở thành phương pháp hình ảnh học trong thực hành lâm sàng BTBS [19-21]. Tương tư như siêu âm tim qua thành ngực, siêu âm 3 chiều vẫn bị giới hạn bởi cửa sổ siêu âm của bệnh nhân, mặc dù sử dụng thuốc cản âm tiêm tĩnh mạch có thể khắc phục hạn chế này. Siêu âm tim qua thực quản không có những hạn chế tương tự; tuy nhiên, đây không phải là 1 thủ thuật hoàn toàn không xâm nhập, cần sử dụng thuốc an thần trong nhiều trường hợp và vẫn có nguy cơ chấn thương thực quản. Vai trò của siêu âm trong thực quản được mô tả chi tiết ở phần khác [22-24]. Một trong những vai trò chủ yếu của siêu âm tim qua thực quản ở bệnh nhân BTBS là theo dõi và hướng dẫn cho các thủ thuật trong phòng mổ và trong phòng thông tim [25].
Hình ảnh cộng hưởng từ tim ngày càng trở thành một phương pháp hình ảnh học quan trọng trong lĩnh vực tim bẩm sinh, đặc biệt trong những bệnh nhân có giải phẫu tim phức tạp. Trong phần lớn các trường hợp, cộng hưởng từ tim cung cấp những hình ảnh giải phẫu học chính xác, xác định thể tích của thất và phân suất tống máu, định lượng dòng hở và luồng thông, định lượng dòng chảy mạch máu đặc biệt, mô tả đặc điểm luồng thông và hình ảnh học của các cấu trúc trong lồng ngực ví dụ như mạng mạch máu phổi. Đã có nhiều nghiên cứu tổng kết đánh giá tốt vai trò của cộng hưởng từ tim trong bệnh tim bẩm sinh [26-28]. Trong trường hợp phẫu thuật sửa chữa bệnh tim phức tạp ở người lớn, cộng hưởng từ tim cho phép thấy rõ màng ngăn, ống dẫn, và luồng thông chủ-phổi (cavopulmonary shunt) [29-31]. Tương tự siêu âm tim, những tiến bộ kỹ thuật mới của cộng hưởng từ tim cung cấp nhiều thông tin hơn bao gồm vùng cơ tim thiếu máu cục bộ, cơ tim còn sống, và hiện tượng căn mô (tissue strain). Mặc dù hiếm, tác dụng phụ của thuốc cản từ gadolinium đã được báo cáo và có thể rất nặng, đặc biệt trên bệnh nhân có bệnh thận tiến triển [32]. Cộng hưởng từ tim có thể khó thực hiện với bệnh nhân có hội chứng hoảng loạn trong không gian kín, nhưng trường hợp này, bệnh nhân có thể được điều trị với thuốc giảm lo âu trước thủ thuật. Sự hợp tác của bệnh nhân là cần thiết, và thời gian thực hiện có thể là yếu tố hạn chế, nhưng thời gian làm cộng hưởng từ tim có thể được cải thiện. Trong tương lai gần, cộng hưởng từ tim trong thực hành lâm sàng có thể sẽ được thực hiện trong 1 nhịp ngưng thở (single breath-hold) hoặc 1 chu kỳ thở bình thường (free-breathing state). Trong bệnh tim bẩm sinh, một trong những khó khăn lớn nhất là không thực hiện được cộng hưởng từ tim trên bệnh nhân có đặt máy tạo nhịp hoặc máy phá rung, tuy rằng những dây tạo nhịp thích hợp với cộng hưởng từ tim đang được hoàn thiện. Do không sử dụng X quang, cộng hưởng từ tim có thể sử dụng cho phụ nữ mang thai khi có chỉ định, tuy nhiên hầu hết các trung tâm đều tránh sử dụng trong 3 tháng đầu thai kỳ [33].
Tương tự cộng hưởng từ tim, sự phát triển kỹ thuật đã làm cho chụp cắt lớp đa bình diện (multidetector CT) trở thành một công cụ vượt trội để cho đánh giá cấu trúc tim– phổi trong các bệnh lý tim bẩm sinh [34-36]. Chụp cắt lớp cũng cho phép đánh giá giải phẫu mạch vành [37]. Hình ảnh nhiễu (artifacts) trên cộng hưởng từ do những thiết bị như stent, van tim, dây thép khâu xương ức có thể được khắc phục bằng hình chụp cắt lớp (Hình 13.1). Quan trọng nhất, chụp cắt lớp có thể sử dụng được với bệnh nhân có đặt máy tạo nhịp và máy phá rung. Tuy nhiên, chụp cắt lớp không có khả năng cung cấp những thông tin huyết động học nhưng cộng hưởng từ. Hình ảnh chụp cắt lớp phụ thuộc vào nhịp tim, và bệnh nhân có thể cần điều trị trước với thuốc ức chế beta. Những thế hệ máy chụp cắt lớp đa bình diện mới, với ưu điểm ghi lại được hình ảnh trong 1 chu chuyển tim, có thể làm giảm sự cần thiết của thuốc ức chế beta. Dị ứng thuốc cản quang là một biến chứng nặng khác, mặc dù ít xảy ra hơn với các thuốc cản quang thế hệ mới. Hạn chế chính của chụp cắt lớp là phơi nhiễm bức xạ ở bệnh nhân trẻ tuổi; cần thận trọng với bệnh nhân cần thực hiện nhiều lần. Mặc dù liều lượng bức xạ thay đổi bởi nhiều yếu tố, nhưng thường dao động từ 5-20 mSv cho một lần chụp cắt lớp có tiêm thuốc cản quang. [38-40]
(a) 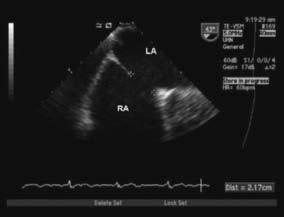 (b)
(b) 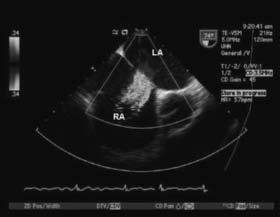
Hình 13.1: Mặt cắt bicaval trên siêu âm tim qua thực quản cho thấy thông liên nhĩ lỗ thứ phát kích thước 2.2cm (1a) với luồng thông màu trái – phải qua tổn thương (1b). RA: nhĩ phải, LA: nhĩ trái.
Các phương pháp ghi hình ảnh dùng đồng vị phóng xạ (nuclear imaging) bao gồm: (1) Chụp mạch máu và buồng tim bằng phóng xạ (radionuclide angiography or ventriculography- RNA); (2) Chụp cắt lớp điện toán phóng photon đơn (Single photon emission computed tomography-SPECT); (3) Chụp cắt lớp phóng positron (Positron emission tomography-PET). RNA có thể dùng để đo phần suất tống máu lúc nghỉ [41] , lúc gắng sức [42,43] và tỷ lệ shunt trái-phải (left-to-right shunt fraction) [44]. SPECT với thallium-201 hoặc technetium-99m dùng để đánh giá tưới máu và sống còn của cơ tim. Các thông tin này có thể cần thiết ở các bệnh nhân có bất thường bẩm sinh động mạch vành hoặc bất thường dòng chảy sau phẫu thuật Jatene cắm lại vị trí động mạch vành [45]. Bệnh nhân sau phẫu thuật Mustard cũng có thể có bất thường tưới máu [46]. Hình ảnh tưới máu phổi có thể giúp xác định các luồng thông tạm còn họat động. PET có thể định lượng tưới máu và chuyển hóa cơ tim. Kỹ thuật này cần sử dụng chất đánh dấu tưới máu như rubidium-82 hoặc [13N] ammonia và chất đánh dấu chuyển hóa như F18 F- labeled 2-flouro-2-deoxyglucose. Hiện tại, PET không được sử dụng thường quy trong BTBS, tuy nhiên có thể có ích trong một số trường hợp đặc biệt. Hạn chế chính của các phương pháp ghi hình ảnh dùng đồng vị phóng xạ là phơi nhiễm bức xạ với liều từ 8-25 mSv cho một lần thực hiện. [39-48]
Chụp mạch máu là một thủ thuật xâm nhập và thường không được sử dụng thường quy, nhưng rất hữu ích trong những trường hợp phức tạp khi cần đánh giá cấu trúc giải phẫu hoặc chọn lựa thủ thuật thích hợp. Nguy cơ đi kèm với phương pháp này bao gồm chấn thương mạch máu, chảy máu, huyết khối, rối loạn nhịp và tai biến mạch máu não. Với những tiến bộ trong hình ảnh học không xâm nhập, hiện nay chỉ định chính của thông tim và chụp mạch máu gồm: (1) xác định rõ giải phẫu học và huyết động học trong trường hợp không xác định được chẩn đoán hoặc khi dữ liệu hình ảnh không xâm nhập không phù hợp; và (2) xác định rõ cấu trúc giải phẫu cần thiết để hướng dẫn cho can thiệp qua da hoặc phẫu thuật.
Một số bệnh tim bẩm sinh
Thông liên nhĩ
Thông liên nhĩ lỗ thứ phát là dạng thường gặp nhất trong thông liên nhĩ. Các thể khác của thông liên nhĩ bao gồm thể xoang tĩnh mạch, thông liên nhĩ lỗ tiên phát, và xoang vành. Luồng thông bất thường ở tầng nhĩ dẫn tới quá tải thất phải thì tâm trương và tăng lưu lượng máu lên phổi. Siêu âm tim là phương pháp đơn giản nhất có thể xác định thông liên nhĩ trong hầu hết các trường hợp (Hình 13.2) [49,50], nhưng cộng hưởng từ tim và chụp cắt lớp có thể sử dụng, nhất là khi cửa sổ siêu âm kém hoặc cần đánh giá thể tích thất phải trong các trường hợp khó xác định [51,52]. Vì thông liên nhĩ kiểu xoang tĩnh mạch thường khó xác định qua siêu âm thành ngực, siêu âm qua thực quản tốt hơn trong những trường hợp này, đặc biệt ở người lớn [53]. Tỷ lệ luồng thông (shunt fraction) có thể được tính bằng siêu âm tim, cộng hưởng từ hoặc xạ ký cơ tim bằng cách tính lưu lượng phổi và lưu lượng hệ thống. [54-57]. Hệ quả huyết động của luồng thông trên thất phải có thể xác định bằng đo kích thước thất phải [58]. Cộng hưởng từ tim và chụp cắt lớp đóng vai trò quan trọng trong đánh giá thể tích và chức năng thất phải. Áp lực tâm thu thất phải có thể được tính bằng tốc độ dòng phụt của hở van 3 lá trên siêu âm tim. Hồi lưu bất thường tĩnh mạch phổi có thể thấy được trên siêu âm thực quản, cộng hưởng từ tim, hoặc chụp cắt lớp. Mặc dù siêu âm tim qua thực quản hữu ích trong hướng dẫn thông tim đóng thông liên nhĩ lỗ thứ phát, siêu âm trong buồng tim có thể được sử dụng như một phương tiện thay thế ở nhiều trung tâm [59].
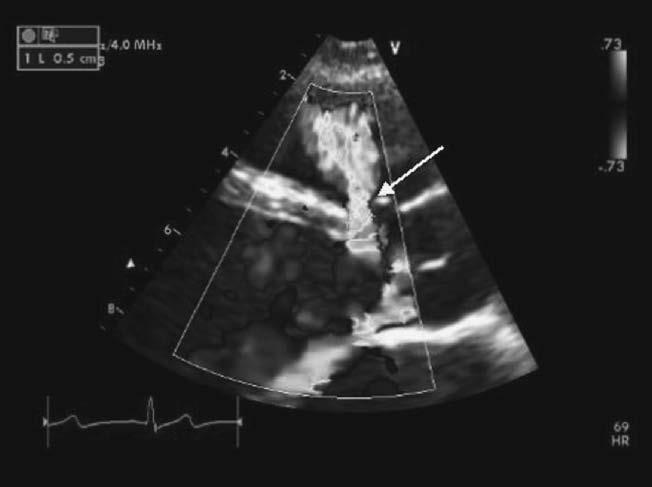
Hình 13.2: Mặt cắt cạnh ức của siêu âm tim qua thành ngực cho thấy phổ Doppler màu băng ngang qua thông liên thất phần màng lỗ nhỏ (mũi tên).
Thông liên thất
Thông liên thất được phân loại dựa trên vị trí: phần màng, phần cơ, buồng nhận, và buồng tống của vách liên thất. Thông liên thất lỗ nhỏ giới hạn (chênh áp cao thì tâm thu giữa thất trái và phải) không gây ra quá tải thể tích thất trái và tăng lưu lượng máu phổi, nhưng trái lại ở bệnh nhân thông liên thất lỗ lớn (áp lực ngang bằng giữa thất trái và thất phải) có nguy cơ cao phát triển thành hội chứng Eisenmenger (tăng áp phổi và luồng thông phải-trái không hồi phục). Dạng thường gặp nhất là thông liên thất quanh màng. Thông liên thất lỗ nhỏ hoặc nhiều lỗ hầu như có thể thấy rõ qua siêu âm thành ngực với Doppler màu (Fig 13.3) [60,61] nhưng cũng có thể quan sát bằng cộng hưởng từ tim [62]. Ở trẻ em, kích thước thông liên thất được đánh giá bằng cách so sánh với đường kính gốc động mạch chủ. Phổ Doppler liên tục cho phép đo đỉnh chênh áp ngang 2 thất thì tâm thu [63,64]. Tuy nhiên, trong trường hợp luồng thông lớn, có thể không có luồng chảy thông nối (no shunt flow) hoặc vận tốc dòng chảy. Lưu lượng shunt có thể ước lượng bằng cách đo Qp:Qs [65] hoặc sử dụng dòng hội tụ gần trên bề mặt vách liên thất bên trái [66]. Cả 2 phương pháp đều có hạn chế. Phân suất luồng thông có thể tính bằng cộng hưởng từ tim hoặc xạ ký. Áp lực tâm thu động mạch phổi phải được đo thường quy, và thường được thực hiện dễ dàng qua siêu âm tim. Các biến chứng muộn có thể phát hiện qua siêu âm tim qua thành ngực và siêu âm tim qua thực quản, bao gồm sa van và hở van động mạch chủ , tắc nghẽn đường ra thất phải thứ phát sau phì đại vùng phễu, hoặc thông liên thất được đóng một phần do lá vách van 3 lá với phình vách màng. Siêu âm tim qua thành ngực và siêu âm tim qua thực quản có thể dùng để xác định kích thước thông liên thất và tương quan vị trí với các cấu trúc trong buồng tim trước khi đóng bằng thông tim. Siêu âm tim qua thực quản có thể được sử dụng trong trường hợp siêu âm qua thành ngực không xác định được chẩn đoán.
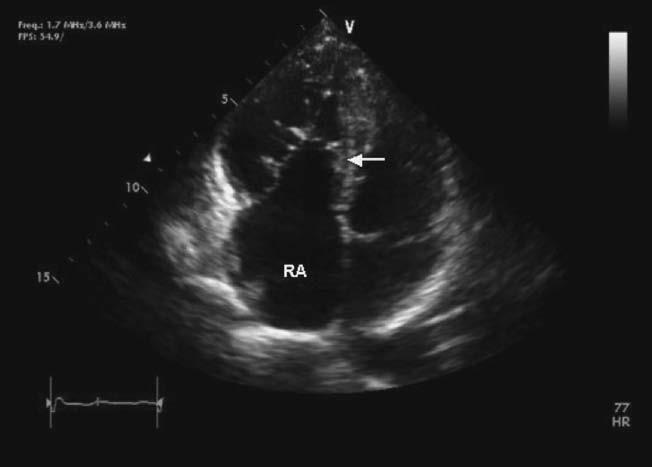
Hình 13.3: Mặt cắt 4 buồng từ mỏm trên siêu âm tim qua thành ngực cho thấy bất thường Ebstein với gắn thấp về phía mỏm tim của lá vách van 3 lá (mũi tên) và dãn nhĩ phải do nhĩ hóa của thất phải. RA: nhĩ phải.
Còn ống động mạch
Còn ống động mạch kích thước nhỏ gây ra quá tải tâm trương thất trái. Phổ liên tục vận tốc cao của luồng thông có thể thấy được trên siêu âm tim thành ngực nhưng cũng có thể quan sát được trên cộng hưởng từ tim và chụp cắt lớp [67-71]. Đỉnh chênh áp giữa áp lực động mạch chủ và động mạch phổi có thể được đo và nếu cần, vị trí, kích thước, và đường kính lớn nhất của ống động mạch có thể quan sát được với cộng hưởng từ tim và chụp cắt lớp trước khi can thiệp. Siêu âm qua thành ngực được sử dụng để tính áp lực tâm thu thất phải. Trong trường hợp ống động mạch lớn kèm theo hội chứng Eisenmenger, có thể không phát hiện dòng chảy trên siêu âm qua thành ngực, và tiêm dung dịch muối cản âm có thể cần thiết để xác định luồng thông ngoài tim. Siêu âm tim, chụp cộng hưởng từ tim, chụp cắt lớp có thể xác định ảnh hưởng của luồng thông trên kích thước và chức năng thất trái.
Tắc nghẽn đường ra thất phải
Siêu âm qua thành ngực là phương pháp đơn giản đánh giá hẹp van động mạch và hệ quả huyết động trên thất phải [72,73]. Chụp cộng hưởng từ tim và chụp cắt lớp rất hữu ích cho khảo sát thân, nhánh chính và nhánh xa động mạch phổi. Siêu âm tim có thể giúp hướng dẫn thông tim thay van động mạch phổi.
Tứ chứng Fallot
Tứ chứng Fallot là một trong những dạng thường gặp của bệnh tim bẩm sinh tím, và phần lớn bệnh nhân này đều phải phẫu thuật sửa chữa trong tim. Phẫu thuật này bao gồm, đóng thông liên thất bằng miếng vá, cắt bỏ bớt phần phễu, và trong vài trường hợp phải đặt miếng vá ngang vòng van hoặc tạo hình động mạch phổi. Nhiều bệnh nhân có thể có hở van động mạch phổi tồn lưu, hệ quả là dãn và suy thất phải có thể tiến triển khi hở van động mạch phổi nhiều. Mặc dù có giá trị tiên lượng cao, nhưng đánh giá hở van động mạch phổi vẫn rất khó khăn. Đánh giá hở van động mạch phổi có thể thực hiện bởi siêu âm tim [74,75], nhưng chụp cộng hưởng từ tim đo chính xác hơn với phase contract methods hoặc sự thay đổi của thể tích nhát bóp (Hình. 13.4) [76]. Hiện tượng trào ngược ở từng nhánh động mạch phổi cần được khảo sát riêng biệt bằng cộng hưởng từ [77]. Quan trọng hơn, tác động của dòng trào ngược trên thất phải có thể dùng để đánh giá kích thước và chức năng thất phải [78-80]. Túi phình đường thóat thất phải có ảnh hưởng lớn đến chức năng thất phải [81,82]. Chức năng tâm thu thất trái cũng nên được đánh giá cùng lúc bởi vì có giá trị tiên lượng. Sợi hóa thất phát hiện bằng hình ảnh tăng tín hiệu gadolinium trên cộng hưởng từ tim cũng có giá trị tiên lượng [83]. Do bệnh động mạch chủ thường đi kèm tứ chứng Fallot, đo kích thước gốc động mạch chủ nên được thực hiện định kỳ.
(a) 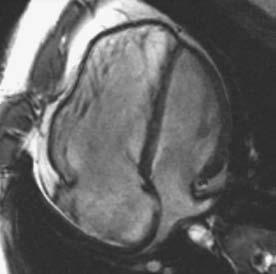 (b)
(b) 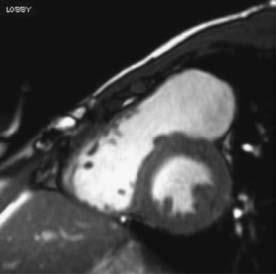
(c) 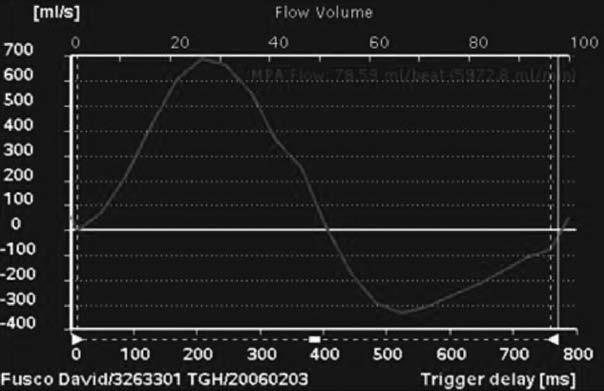
Hình 13.4: Hình ảnh tĩnh của mặt cắt 4 buồng (a) và trục ngang (b) của chụp cộng hưởng từ tim cho thấy dãn thất phải ở bệnh nhân đã phẫu thuật sửa chữa tứ chứng Fallot và hở phổi nặng. Hình ảnh cộng hưởng từ mã hóa vận tốc (Velocity-encoded cine magnetic resonance imaging) (c) của đường biểu diễn vận tốc theo thời gian của dòng phụt (a flow-velocity-time curve) cho thấy hở van động mạch phổi nặng. RV: thất phải; LV: thất trái.
Hẹp eo động mạch chủ
Hầu hết bệnh nhân hẹp eo động mạch chủ đều phải phẫu thuật với sửa chữa bằng mảnh động mạch dưới đòn trái, sửa động mạch chủ với miếng vá, nối tận-tận hoặc bắc cầu nối (jump grafts). Trong vài trường hợp, đặc biệt ở người lớn với tái hẹp, có thể thực hiện nong hoặc đặt stent mạch máu. Biến chứng muộn liên quan tới phương pháp phẫu thuật như túi phình ở bệnh nhân sửa chữa bằng miếng vá và tái hẹp ở bệnh nhân phẫu thuật nối tận-tận. Siêu âm tim không phải là biện pháp lý tưởng để đánh giá toàn bộ động mạch chủ [84-90], do đó, các phương pháp khác như chụp cộng hưởng từ tim và chụp cắt lớp có cản quang rất quan trọng trong đánh giá hình ảnh học động mạch chủ (Hình 13.5). Siêu âm Doppler có thể hữu ích để đo chênh áp và đánh giá huyết động học của hẹp eo động mạch chủ [91]. Tuy nhiên Doppler cũng có hạn chế là rất khó để xác định vị trí vận tốc tối đa ngang chỗ hẹp eo. Hơn nữa, mức độ hẹp có thể bị đánh giá thấp do tuần hoàn bàng hệ có thể làm tăng lưu lượng sau chỗ hẹp, làm giảm chênh áp. Đánh giá lầm có thể xảy ra khi vận tốc phần gần của eo động mạch chủ bị bỏ sót, nên phải tính bằng phương trình Bernouilli. Đánh giá thường không đúng khi chỗ hẹp eo kéo dài, lúc này phương trình Bernouilli không còn giá trị. Cộng hưởng từ tim có thể dùng thay thế đánh giá lưu lượng tại động mạch chủ xuống [92]. Trong trường hợp hẹp eo động mạch chủ nặng, chụp cộng hưởng từ tim hoặc chụp cắt lớp thấy được nhiều tuần hoàn bàng hệ. Biến chứng của hẹp eo động mạch chủ có thể phát hiện bao gồm phì đại thất trái, rối loạn vận động vùng do bệnh mạch vành tiên phát đi kèm với bệnh lý van động mạch chủ, và phình động mạch chủ lên. Riêng túi phình tại vị trí hẹp được đánh giá tốt nhất bằng hình ảnh cộng hưởng từ tim và chụp cắt lớp [93].
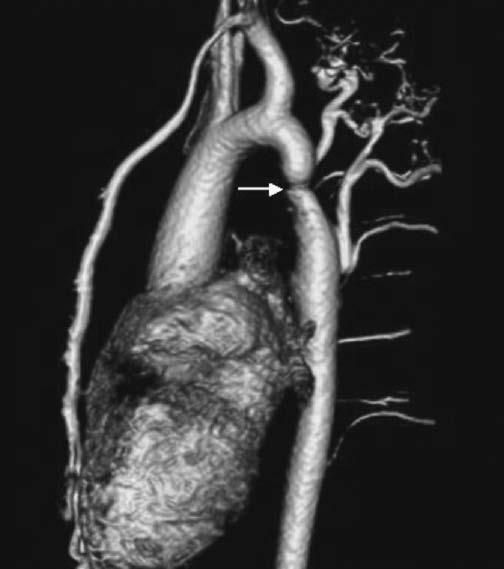
Hình 13.5: Cộng hưởng từ tái tạo lập thể hẹp eo động mạch chủ cho thấy hình ảnh hẹp điển hình đoạn xa trước động mạch dưới đòn trái (mũi tên) và hệ thống tuần hoàn bàng hệ.
Bất thường Ebstein
Siêu âm tim được dùng để đánh giá độ nặng của bất thường Ebstein với gắn thấp về phía mỏm tim của lá vách van 3 lá, loạn sản lá vách và/hoặc lá sau, hở van 3 lá, hoặc hẹp van 3 lá (rất hiếm) (Hình 13.6) [94-95]. Kích thước, chức năng của thất phải và phần nhĩ hóa của nhĩ phải rất quan trọng để xác định tiên lượng bệnh. Cộng hưởng từ tim có thể là phương pháp hình ảnh học thay thế. [96]. Siêu âm tim đánh giá rất tốt độ dài và di động của lá trước để quyết định phẫu thuật. Tồn tại lỗ bầu dục và thông liên nhĩ thường đi kèm và luồng thông đảo chiều (phải-trái) ở tầng nhĩ có thể xảy ra khi bệnh tiến triển.
Kết quả trường hợp lâm sàng:
Tổn thương gây rối loạn huyết động học của bệnh nhân tứ chứng Fallot có thể gây ra nhịp nhanh thất. Do đó, bệnh nhân được thực hiện siêu âm tim qua thành ngực và chụp cộng hưởng từ tim để đánh giá giải phẫu tim. Siêu âm tim phát hiện dãn thất phải với rối loạn chức năng tâm thu thất phải trung bình, hở van động mạch phổi nặng, hở van 3 lá trung bình, và áp lực tâm thu thất phải bình thường. Chụp cộng hưởng từ tim cho thấy thể tích cuối tâm trương thất phải 160 cc/m2, phân suất tống máu thất phải 30%, và phần xuất dòng hở phổi 40%. Kích thước và chức năng thất trái bình thường, không hẹp các nhánh động mạch phổi. bệnh nhân được phẫu thuật thay van động mạch phổi và hủy ổ loạn nhịp bằng lạnh (cryoablation) trong lúc phẫu thuật.
Tài liệu tham khảo:
- Therrien J, Dore A, Gersony W, et al. Canadian Cardiovascular Society Consensus Conference 2001 update: recommendations for the management of adults with congenital heart disease. Part I. Can J Cardiol 2001;17:940–59.
- Therrien J, Gatzoulis M, Graham T, et al. Canadian Cardiovascular Society Consensus Conference 2001 update: recommendations for the Management of Adults with Congenital Heart Disease. Part II. Can J Cardiol 2001;17:1029–50.
- Therrien J, Warnes C, Daliento L, et al. Canadian Cardiovascular Society Consensus Conference 2001 update: recommendations for the management of adults with congenital heart disease. Part III. Can J Cardiol 2001;17:1135–58.
- Deanfield J, Thaulow E, Warnes C, et al. Management of grown up congenital heart disease. Eur Heart J 2003;24:1035–84.
- Schroeder S, Achenbach S, Bengel F, et al. Cardiac computed tomography: indications, applications, limitations, and training requirements: report of a Writing Group deployed by theWorking Group Nuclear Cardiology and Cardiac CT of the European Society of Cardiology and the European Council of Nuclear Cardiology. Eur Heart J 2008;29:531–56.
- Pennell DJ, Sechtem UP, Higgins CB, et al. Clinical indications for cardiovascular magnetic resonance (CMR): Consensus Panel report. Eur Heart J 2004;25:1940–65.
- Ritchie J, Bateman TM, Bonow RO, et al. Guidelines for clinical use of cardiac radionuclide imaging. A report of the American Heart Association/American College of Cardiology Task Force on Assessment of Diagnostic and Therapeutic Cardiovascular Procedures, Committee on Radionuclide Imaging, developed in collaboration with the American Society of Nuclear Cardiology. Circulation 1995;91:1278–303.
- Douglas PS, Khandheria B, Stainback RF, et al. ACCF/ASE/ACEP/ASNC/SCAI/ SCCT/SCMR 2007 appropriateness criteria for transthoracic and transesophageal echocardiography: a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness CriteriaWorking Group, American Society of Echocardiography, American College of Emergency Physicians, American Society of Nuclear Cardiology, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and the Society for Cardiovascular Magnetic Resonance endorsed by the American College of Chest Physicians and the Society of Critical Care Medicine. J Am Coll Cardiol 2007;50: 187–204.
- Hendel RC, PatelMR,KramerCM,et al.ACCF/ACR/SCCT/SCMR/ASNC/NASCI/ SCAI/SIR 2006 appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging: a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group, American College of Radiology, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance, American Society of Nuclear Cardiology, North American Society for Cardiac Imaging, Society for Cardiovascular Angiography and Interventions, and Society of Interventional Radiology. J Am Coll Cardiol 2006;48:1475–97.
- Kaul S, Tei C, Hopkins JM, Shah PM. Assessment of right ventricular function using two-dimensional echocardiography. Am Heart J 1984;107:526–31.
- Ghio S, Recusani F, Klersy C, et al. Prognostic usefulness of the tricuspid annular plane systolic excursion in patients with congestive heart failure secondary to idiopathic or ischemic dilated cardiomyopathy. Am J Cardiol 2000;85:837–42.
- Meluzin J, Spinarova L, Bakala J, et al. Pulsed Doppler tissue imaging of the velocity of tricuspid annular systolic motion; a new, rapid, and non-invasive method of evaluating right ventricular systolic function. Eur Heart J 2001;22:340–8.
- Eidem BW, O’Leary PW, Tei C, Seward JB. Usefulness of the myocardial performance index for assessing right ventricular function in congenital heart disease. Am J Cardiol 2000;86:654–8.
- Salehian O, Schwerzmann M, Merchant N, et al. Assessment of systemic right ventricular function in patients with transposition of the great arteries using the myocardial performance index: comparison with cardiac magnetic resonance imaging. Circulation 2004;110:3229–33.
- Schwerzmann M, Samman AM, Salehian O, et al. Comparison of echocardiographic and cardiac magnetic resonance imaging for assessing right ventricular function in adults with repaired tetralogy of fallot. Am J Cardiol 2007;99:1593–7.
- Eidem BW, Tei C, O’Leary PW, et al. Nongeometric quantitative assessment of right and left ventricular function: myocardial performance index in normal children and patients with Ebstein anomaly. J Am Soc Echocardiogr 1998;11:849–56.
- Vogel M, Schmidt MR, Kristiansen SB, et al. Validation of myocardial acceleration during isovolumic contraction as a novel noninvasive index of right ventricular contractility: comparison with ventricular pressure-volume relations in an animal model. Circulation 2002;105:1693–9.
- Frigiola A, Redington AN, Cullen S,Vogel M. Pulmonary regurgitation is an important determinant of right ventricular contractile dysfunction in patients with surgically repaired tetralogy of Fallot. Circulation 2004;110:II153–7.
- Niemann PS, Pinho L, Balbach T, et al. Anatomically oriented right ventricular volume measurements with dynamic three-dimensional echocardiography validated by 3- Tesla magnetic resonance imaging. J Am Coll Cardiol 2007;50:1668–76.
- Takahashi K, Guerra V, Roman KS, et al. Three-dimensional echocardiography improves the understanding of the mechanisms and site of left atrioventricular valve regurgitation in atrioventricular septal defect. J Am Soc Echocardiogr 2006;19: 1502–10.
- Kardon RE, Cao QL, Masani N, et al. New insights and observations in threedimensional echocardiographic visualization of ventricular septal defects: experimental and clinical studies. Circulation 1998;98:1307–14.
- Marelli AJ, Child JS, Perloff JK. Transesophageal echocardiography in congenital heart disease in the adult. Cardiol Clin 1993;11:505–20.
- Miller-Hance WC, Silverman NH. Transesophageal echocardiography (TEE) in congenital heart disease with focus on the adult. Cardiol Clin 2000;18:861–92.
- Masani ND. Transoesophageal echocardiography in adult congenital heart disease. Heart 2001;86(Suppl 2):II30–40.
- Smallhorn JF. Intraoperative transesophageal echocardiography in congenital heart disease. Echocardiography 2002;19:709–23.
- Geva T, Sahn D, Powell AJ. Magnetic resonance imaging of congentila heart disease in adults. Progr Pediatr Cardiol 2003;17:21–39.
- Boxt LM. Magnetic resonance and computed tomographic evaluation of congenital heart disease. J Magn Reson Imaging 2004;19:827–47.
- Wald RM, Powell AJ. Simple congenital heart lesions. J Cardiovasc Magn Reson 2006;8:619–31.
- Fogel MA, Hubbard A,Weinberg PM. A simplified approach for assessment of intracardiac baffles and extracardiac conduits in congenital heart surgery with two- and three-dimensional magnetic resonance imaging. Am Heart J 2001;142:1028–36.
- Brown DW, Gauvreau K, Powell AJ, et al. Cardiac magnetic resonance versus routine cardiac catheterization before bidirectional glenn anastomosis in infants with functional single ventricle: a prospective randomized trial. Circulation 2007;116: 2718–25.
- Canter CE, Gutierrez FR, Molina P, et al. Noninvasive diagnosis of right-sided extracardiac conduit obstruction by combined magnetic resonance imaging and continuouswave Doppler echocardiography. J Thorac Cardiovasc Surg 1991; 101:724–31.
- Cowper SE, Robin HS, Steinberg SM, et al. Scleromyxoedema-like cutaneous diseases in renal-dialysis patients. Lancet 2000;356:1000–1.
- Kanal E. Pregnancy and the safety of magnetic resonance imaging. Magn Reson Imaging Clin N Am 1994;2:309–17.
- Cook SC, Raman SV. Unique application of multislice computed tomography in adults with congenital heart disease. Int J Cardiol 2007;119:101–6.
- GooHW, Park IS, Ko JK, et al. Computed tomography for the diagnosis of congenital heart disease in pediatric and adult patients. Int J Cardiovasc Imaging 2005;21:347–65, discussion 367.
- Ou P, Celermajer DS, Calcagni G, et al. Three-dimensional CT scanning: a new diagnostic modality in congenital heart disease. Heart 2007;93:908–13.
- Manghat NE, Morgan-Hughes GJ, Marshall AJ, Roobottom CA. Multidetector row computed tomography: imaging congenital coronary artery anomalies in adults. Heart 2005;91:1515–22.
- Coles DR, Smail MA, Negus IS, et al. Comparison of radiation doses from multislice computed tomography coronary angiography and conventional diagnostic angiography. J Am Coll Cardiol 2006;47:1840–5.
- Einstein AJ, Moser KW, Thompson RC, et al. Radiation dose to patients from cardiac diagnostic imaging. Circulation 2007;116:1290–305. Adult Congenital Heart Disease
- Einstein AJ, Henzlova MJ, Rajagopalan S. Estimating risk of cancer associated with radiation exposure from64-slice computed tomography coronary angiography.JAMA 2007;298:317–23.
- Baker EJ, Shubao C, Clarke SE, et al. Radionuclide measurement of right ventricular function in atrial septal defect, ventricular septal defect and complete transposition of the great arteries. Am J Cardiol 1986;57:1142–6.
- Peter CA, Bowyer K, Jones RH. Radionuclide analysis of right and left ventricular response to exercise in patients with atrial and ventricular septal defects. Am Heart J 1983;105:428–35.
- Reduto LA, Berger HJ, Johnstone DE, et al. Radionuclide assessment of right and left ventricular exercise reserve after total correction of tetralogy of Fallot. Am J Cardiol 1980;45:1013–8.
- Baker EJ, Ellam SV, Lorber A, et al. Superiority of radionuclide over oximetric measurement of left to right shunts. Br Heart J 1985;53:535–40.
- Hauser M, Bengel FM, Kuhn A, et al. Myocardial blood flow and flow reserve after coronary reimplantation in patients after arterial switch and ross operation. Circulation 2001;103:1875–80.
- Millane T, Bernard EJ, Jaeggi E, et al. Role of ischemia and infarction in late right ventricular dysfunction after atrial repair of transposition of the great arteries. J Am Coll Cardiol 2000;35:1661–8.
- Dedkov EI, Perloff JK, Tomanek RJ, et al. The coronary microcirculation in cyanotic congenital heart disease. Circulation 2006;114:196–200.
- Hesse B, Tagil K, Cuocolo A, et al. EANM/ESC procedural guidelines for myocardial perfusion imaging in nuclear cardiology. Eur J Nucl Med Mol Imaging 2005;32:855–97.
- Shub C, Dimopoulos IN, Seward JB, et al. Sensitivity of two-dimensional echocardiography in the direct visualization of atrial septal defect utilizing the subcostal approach: experience with 154 patients. J Am Coll Cardiol 1983;2:127–35.
- Suzuki Y, Kambara H, Kadota K, et al. Detection of intracardiac shunt flow in atrial septal defect using a real-time two-dimensional color-coded Doppler flow imaging system and comparison with contrast two-dimensional echocardiography. Am J Cardiol 1985;56:347–50.
- Diethelm L, Dery R, Lipton MJ, Higgins CB. Atrial-level shunts: sensitivity and specificity of MR in diagnosis. Radiology 1987;162:181–6.
- JacobsteinMD,Fletcher BD, Goldstein S, Riemenschneider TA. Evaluation of atrioventricular septal defect by magnetic resonance imaging. Am J Cardiol 1985;55:1158–61.
- Kronzon I, Tunick PA, Freedberg RS, et al. Transesophageal echocardiography is superior to transthoracic echocardiography in the diagnosis of sinus venosus atrial septal defect. J Am Coll Cardiol 1991;17:537–42.
- Kitabatake A, Inoue M, Asao M, et al. Noninvasive evaluation of the ratio of pulmonary to systemic flow in atrial septal defect by duplex Doppler echocardiography. Circulation 1984;69:73–9.
- Brenner LD, Caputo GR, Mostbeck G, et al. Quantification of left to right atrial shunts with velocity-encoded cine nuclear magnetic resonance imaging. J Am Coll Cardiol 1992;20:1246–50.
- Dittmann H, Jacksch R, Voelker W, et al. Accuracy of Doppler echocardiography in quantification of left to right shunts in adult patients with atrial septal defect. J Am Coll Cardiol 1988;11:338–42.
- Vargas Barron J, Sahn DJ, Valdes-Cruz LM, et al. Clinical utility of two-dimensional doppler echocardiographic techniques for estimating pulmonary to systemic blood flow ratios in children with left to right shunting atrial septal defect, ventricular septal defect or patent ductus arteriosus. J Am Coll Cardiol 1984;3:169–78.
- Chen C, Kremer P, Schroeder E, et al. Usefulness of anatomic parameters derived from two-dimensional echocardiography for estimating magnitude of left to right shunt in patients with atrial septal defect. Clin Cardiol 1987;10:316–21.
- Mullen MJ, Dias BF, Walker F, et al. Intracardiac echocardiography guided device closure of atrial septal defects. J Am Coll Cardiol 2003;41:285–92.
- Ortiz E, Robinson PJ, Deanfield JE, et al. Localisation of ventricular septal defects by simultaneous display of superimposed colour Doppler and cross sectional echocardiographic images. Br Heart J 1985;54:53–60.
- Ludomirsky A, Huhta JC, Vick GW 3rd, Murphy DJ Jr, Danford DA, Morrow WR. Color Doppler detection of multiple ventricular septal defects. Circulation 1986;74: 1317–22.
- Didier D, Higgins CB. Identification and localization of ventricular septal defect by gated magnetic resonance imaging. Am J Cardiol 1986;57:1363–8.
- Murphy DJ Jr, Ludomirsky A, Huhta JC. Continuous-wave Doppler in children with ventricular septal defect: noninvasive estimation of interventricular pressure gradient. Am J Cardiol 1986;57:428–32.
- Houston AB, Lim MK, Doig WB, et al. Doppler assessment of the interventricular pressure drop in patients with ventricular septal defects. Br Heart J 1988;60:50–6.
- Kurokawa S, Takahashi M, Katoh Y, et al. Noninvasive evaluation of the ratio of pulmonary to systemic flow in ventricular septal defect by means of Doppler twodimensional echocardiography. Am Heart J 1988;116:1033–44.
- Moises VA, Maciel BC, Hornberger LK, et al. A new method for noninvasive estimation of ventricular septal defect shunt flow by Doppler color flow mapping: imaging of the laminar flow convergence region on the left septal surface. J Am Coll Cardiol 1991;18:824–32.
- Smallhorn JF, Huhta JC, Anderson RH, Macartney FJ. Suprasternal cross-sectional echocardiography in assessment of patient ducts arteriosus. Br Heart J 1982;48:321–30.
- Swensson RE, Valdes-Cruz LM, Sahn DJ, et al. Real-time Doppler color flow mapping for detection of patent ductus arteriosus. J Am Coll Cardiol 1986;8:1105–12.
- Liao PK, Su WJ, Hung JS. Doppler echocardiographic flow characteristics of isolated patent ductus arteriosus: better delineation by Doppler color flow mapping. J Am Coll\ Cardiol 1988;12:1285–91.
- Goitein O, Fuhrman CR, Lacomis JM. Incidental finding on MDCT of patent ductus arteriosus: use of CT and MRI to assess clinical importance. AJR Am J Roentgenol 2005;184:1924–31.
- Morgan-Hughes GJ, Marshall AJ, Roobottom C. Morphologic assessment of patent ductus arteriosus in adults using retrospectively ECG-gated multidetector CT. AJR Am J Roentgenol 2003;181:749–54.
- Lima CO, Sahn DJ, Valdes-Cruz LM, et al. Noninvasive prediction of transvalvular pressure gradient in patients with pulmonary stenosis by quantitative twodimensional echocardiographic Doppler studies. Circulation 1983;67:866–71.
- Mulhern KM, Skorton DJ. Echocardiographic evaluation of isolated pulmonary valve disease in adolescents and adults. Echocardiography 1993;10:533–43.206 Adult
- Silversides CK,Veldtman GR, Crossin J, et al. Pressure half-time predicts hemodynamically significant pulmonary regurgitation in adult patients with repaired tetralogy of fallot. J Am Soc Echocardiogr 2003;16:1057–62.
- Li W, Davlouros PA, Kilner PJ, et al. Doppler-echocardiographic assessment of pulmonary regurgitation in adults with repaired tetralogy of Fallot: comparison with cardiovascular magnetic resonance imaging. Am Heart J 2004;147:165–72.
- Rebergen SA, Chin JG, Ottenkamp J, et al. Pulmonary regurgitation in the late postoperative follow-up of tetralogy of Fallot. Volumetric quantitation by nuclear magnetic resonance velocity mapping. Circulation 1993;88:2257–66.
- Kang IS, Redington AN, Benson LN, et al. Differential regurgitation in branch pulmonary arteries after repair of tetralogy of Fallot: a phase-contrast cine magnetic resonance study. Circulation 2003;107:2938–43.
- Menteer J, Weinberg PM, Fogel MA. Quantifying regional right ventricular function in tetralogy of Fallot. J Cardiovasc Magn Reson 2005;7:753–61.
- Raman SV, Cook SC, McCarthy B, Ferketich AK. Usefulness of multidetector row computed tomography to quantify right ventricular size and function in adults with either tetralogy of Fallot or transposition of the great arteries. Am J Cardiol 2005;95: 683–6.
- HelbingWA, de Roos A. Clinical applications of cardiac magnetic resonance imaging after repair of tetralogy of Fallot. Pediatr Cardiol 2000;21:70–9.
- Davlouros PA, Kilner PJ, Hornung TS, et al. Right ventricular function in adults with repaired tetralogy of Fallot assessed with cardiovascular magnetic resonance imaging: detrimental role of right ventricular outflow aneurysms or akinesia and adverse right-to-left ventricular interaction. J Am Coll Cardiol 2002;40:2044–52.
- Uebing A, Gibson DG, Babu-Narayan SV, et al. Right ventricular mechanics and QRS duration in patients with repaired tetralogy of Fallot: implications of infundibular disease. Circulation 2007;116:1532–9.
- Babu-Narayan SV, Kilner PJ, LiW, et al. Ventricular fibrosis suggested by cardiovascular magnetic resonance in adults with repaired tetralogy of fallot and its relationship to adverse markers of clinical outcome. Circulation 2006;113:405–13.
- Therrien J, Thorne SA,Wright A, et al. Repaired coarctation: a “cost-effective” approach to identify complications in adults. J Am Coll Cardiol 2000;35:997–1002.
- von Schulthess GK, Higashino SM, Higgins SS, Didier D, Fisher MR, Higgins CB. Coarctation of the aorta: MR imaging. Radiology 1986;158:469–74.
- Simpson IA, Chung KJ, Glass RF, et al. Cine magnetic resonance imaging for evaluation of anatomy and flow relations in infants and children with coarctation of the aorta. Circulation 1988;78:142–8.
- Rees S, Somerville J, Ward C, et al. Coarctation of the aorta: MR imaging in late postoperative assessment. Radiology 1989;173:499–502.
- Hager A, Kaemmerer H, Leppert A, et al. Follow-up of adults with coarctation of the aorta: comparison of helical CT and MRI, and impact on assessing diameter changes. Chest 2004;126:1169–76.
- Becker C, Soppa C, Fink U, et al. Spiral CT angiography and 3D reconstruction in patients with aortic coarctation. Eur Radiol 1997;7:1473–7.
- Soulen RL, Kan J, Mitchell S, White RI Jr. Evaluation of balloon angioplasty of coarctation restenosis by magnetic resonance imaging. Am J Cardiol 1987;60:343–5.
- Tan JL, Babu-Narayan SV, Henein MY, et al. Doppler echocardiographic profile and indexes in the evaluation of aortic coarctation in patients before and after stenting. J Am Coll Cardiol 2005;46:1045–53.
- Nielsen JC, Powell AJ, Gauvreau K, et al. Magnetic resonance imaging predictors of coarctation severity. Circulation 2005;111:622–8.
- Parks WJ, Ngo TD, PlauthWHJr, et al. Incidence of aneurysm formation after Dacron patch aortoplasty repair for coarctation of the aorta: long-term results and assessment utilizing magnetic resonance angiography with three-dimensional surface rendering. J Am Coll Cardiol 1995;26:266–71.
- Shiina A, Seward JB, Edwards WD, et al. Two-dimensional echocardiographic spectrum of Ebstein’s anomaly: detailed anatomic assessment. JAmColl Cardiol 1984;3:356–70.
- Benson LN, Child JS, Schwaiger M, et al. Left ventricular geometry and function in adults with Ebstein’s anomaly of the tricuspid valve. Circulation 1987;75:353–9.
- Choi YH, Park JH, Choe YH, Yoo SJ.MRimaging of Ebstein’s anomaly of the tricuspid valve. Am J Roentgenol 1994;163:539–43.

Để lại bình luận
Bạn cần phải đăng nhập để đăng bình luận.