Kevin Owusu- Ansah, Zeksen Lim, and Gruschen R. Veldtman
Người dịch: BS Trần Vũ Minh Thư
Một phụ nữ mắc hội chứng Noonan, phát hiện tình trạng tăng áp động mạch phổi nặng lúc 8 tuổi, tồn tại ống động mạch lớn, và giảm độ bão hòa oxy trong máu động mạch (80%). Thông tim chẩn đoán cho thấy áp lực động mạch phổi hệ thống (110/65, trung bình 80 mm Hg), luồng thông trái – phải 0.9:1, và kháng lực mạch máu phổi 30 đơn vị Wood, xác định hội chứng Eisenmenger. Bệnh nhân này được khuyên không nên mang thai và các phương pháp tránh thai khác nhau được thảo luận.
Lúc 36 tuổi, bệnh nhân được bác sĩ địa phương chỉ định trích máu tĩnh mạch (Hb: 21.4 g/dL với HCT: 65%). Bà ta từ chối vì sợ kim. Tuy nhiên, hơn 5 năm sau đó, bệnh nhân đã 3 lần trích máu tĩnh mạch vì có triệu chứng do tăng độ nhớt máu. Lúc 40 tuổi, bà ta có tình trạng giảm tiểu cầu mức độ vừa với số lượng tiểu cầu là 83.000 (độ bão hòa oxy 75%). Phết máu của bà được mô tả ở hình 5.1.
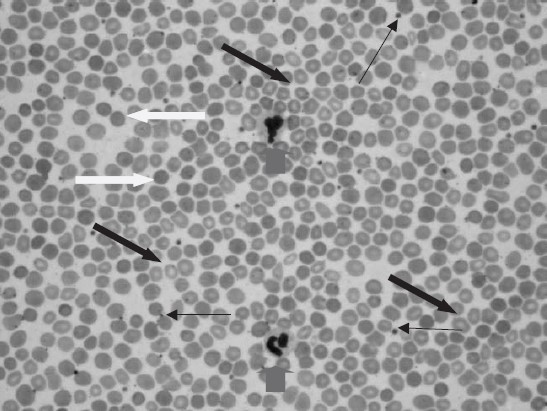
Hình 5.1: Phết máu ngoại biên cho thấy những đặc điểm kinh điển của hội chứng Eisenmenger. Hồng cầu đa sắc kèm tăng hồng cầu lưới (mũi tên đen); hồng cầu hình cầu (mũi tên trắng); giảm số lượng tiểu cầu (mũi tên đen mảnh); và số lượng tế bào lympho bình thường (mũi tên xám).
Trong lúc nhập viện để phẫu thuật sinh thiết khối u tử cung, bệnh nhân ngất rồi ngưng tim ngưng thở và may mắn được cứu sống.
Lúc 43 tuổi, bệnh nhân đau ngực khi gắng sức. Sau đó, bà ta bị cuồng nhĩ, suy tim sung huyết, và suy thận cấp trên nền mạn với protein niệu rõ. Sinh thiết thận cho thấy viêm cầu thận tăng sinh màng. Protein niệu đáp ứng với thuốc ức chế men chuyển và steroid. Cuồng nhĩ phụ thuộc eo được cắt đốt thành công. Bệnh nhân được bắt đầu điều trị với lợi tiểu, ức chế men chuyển, ức chế bêta liều thấp, và kháng đông. Sau đó bà ta được chuyển đến khoa tim bẩm sinh người lớn để tiếp tục điều trị.
Khám thực thể cho thấy: mụn trứng cá ở nửa trên cơ thể, ngón chân dùi trống và độ bão hòa oxy 75%. Độ bão hòa oxy tay phải là 94%. Áp lực tĩnh mạch cảnh là 9 cm trên góc Louis, và có phù ngoại biên. Lồng ngực bên trái gồ lên, P2 lớn, và âm thổi Graham Steell. Ran rít, ran ngáy ở hai bên phổi. Điện tâm đồ 12 chuyển đạo được mô tả ở hình 5.2.
Siêu âm tim 2 chiều và MRI cho thấy rối loạn chức năng tâm thu hai thất nặng, phì đại thất trái vừa, phì đại và dãn thất phải nặng, vách liên thất dẹt (hình 5.3), và hở van 3 lá nặng vừa. Áp lực tâm thu thất phải ước lượng là 130-135 mm Hg. X-Quang ngực thể hiện ở hình 5.4 và CT scan ở hình 5.5.
Bàn luận
Mở đầu
Tăng áp động mạch phổi (TAĐMP) được định nghĩa là áp lực động mạch phổi trung bình (ĐMP) >25 mm Hg lúc nghỉ hoặc áp lực ĐMP > 30 mm Hg lúc gắng sức. TAĐMP được phân loại như sau: vô căn (IPAH), gia đình, TAĐMP thứ phát, hoặc có liên quan đến một số yếu tố nguy cơ được biết [1]. Trước đây, TAĐMP là biến chứng của 10-20% trường hợp dị tật tim bẩm sinh. Trong những năm gần đây, con số này giảm vì phẫu thuật tim phát triển. Hiện tại, ước tính khoảng 4%.
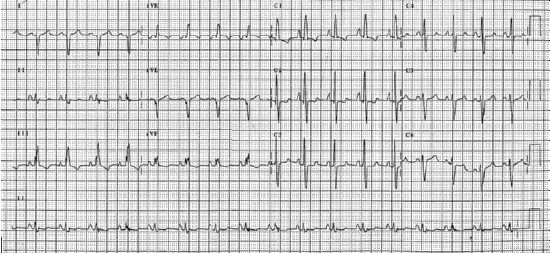
Hình 5.2: Điện tâm đồ 12 chuyển đạo của bệnh nhân Eisenmenger. Điện tâm đồ cho thấy P phế, lớn thất phải, trục lệch phải.
Hậu quả
Tỷ lệ sống còn trong hội chứng Eisenmenger tốt hơn hẳn so với TAĐMP vô căn. Một nghiên cứu đoàn hệ gần đây cho thấy bệnh nhân mắc hội chứng Eisenmenger thường sống trên 50 tuổi [2].
Những bệnh nhân mắc bệnh phức tạp, phân độ chức năng kém, rối loạn nhịp tim, hội chứng Down, suy tim, khoảng QTc và QRS dài, albumin máu thấp, acid uric máu cao có dự hậu xấu. Có nhiều nguyên nhân gây tử vong. Phẫu thuật ngoài tim (lên đến 38%) và thai kỳ (40%) có nguy cơ tử vong rất cao. Các nguyên nhân tử vong khác bao gồm đột tử do tim (21-47%), suy tim sung huyết (23-42%), ho ra máu (3-29%), viêm nội tâm mạc nhiễm trùng (6%), và tai biến mạch máu não (6%) [3-5].
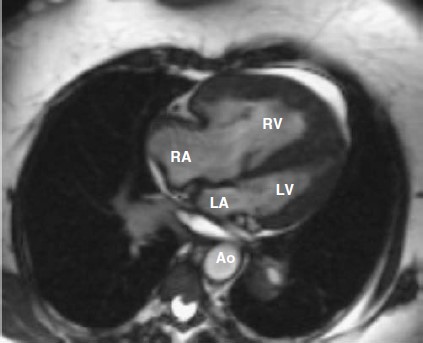
Hình 5.3: MRI tim của bệnh nhân chúng tôi – mặt cắt bốn buồng. Thất phải dày, dãn rõ, chèn ép tương đối thất trái. Ao: động mạch chủ; LA: nhĩ trái; LV: thất trái; RA: nhĩ phải; RV: thất phải.
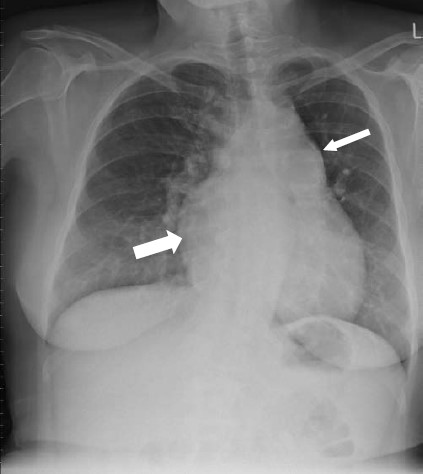
Hình 5.4: X-Quang ngực của bệnh nhân chúng tôi có hình ảnh vẹo cột sống, động mạch phổi dãn, vôi hóa và ống động mạch (mũi tên mảnh), nhĩ phải lớn (mũi tên lớn), và chỉ số tim ngực tăng.
Lịch sử
Năm 1987, Victor Eisenmenger mô tả một bệnh nhân nam 32 tuổi có thông liên thất (TLT) quanh màng, kích thước 2-2,5 cm, tím và suy tim; cuối cùng bệnh nhân này chết vì ho ra máu. Chỉ 50 năm sau, người ta phát hiện ra những trường hợp như vậy có áp lực động mạch phổi ngang mức hệ thống và luồng thông phải – trái. Paul Wood xác định lại sinh lý học của phức hợp Eisenmenger như sau: “ Tăng áp động mạch phổi ngang mức hệ thống, do kháng lực mạch máu phổi cao (>800 dynes. s / cm-6), với luồng thông đảo ngược hoặc hai chiều qua lỗ thông liên thất lớn kích thước 1,5 – 3 cm” [5]. Wood lưu ý rằng một số lớn dị tật tim bẩm sinh có sự thông thương trực tiếp giữa tuần hoàn phổi và tuần hoàn hệ thống (>15 mm đối với TLT, 7 mm đối với cửa sổ phế chủ, và > 30 mm đối với thông liên nhĩ [TLN]) có thể gây ra dạng sinh lý học này.
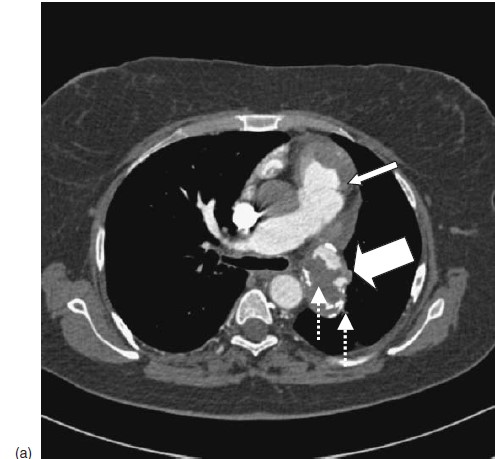
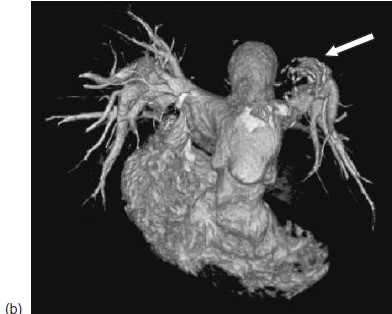
Hình 5.5: CT mạch máu của bệnh nhân. (a) Động mạch phổi gốc dãn lớn (mũi tên mảnh); huyết khối tại chỗ trong động mạch phổi lan rộng trong động mạch phổi trái đoạn gần (LPA)(mũi tên to) với huyết khối cũ bị vôi hóa (mũi tên đứt đoạn) (b) Tái tạo 3 chiều: hình ảnh khuyết thuốc lấp đầy động mạch phổi trái đoạn gần và nhánh thùy trên bị tắc.
Bảng 5.1:Dị tật tim bẩm sinh gây ra sự thông thương trực tiếp giữa tuần hoàn phổi và tuần hoàn hệ thống
|
|
Tổng số trường hợp |
Phản ứng Eisenmenger |
Tần suất phản ứng Eisenmenger (%) |
|
Còn ống động mạch |
180 |
29 |
16 |
|
Cửa sổ phế chủ |
10 |
6 |
60 |
|
Thân chung động mạch |
4 |
4 |
100 |
|
Chuyển vị đại động mạch với thông liên thất |
12 |
7 |
58 |
|
Chuyển vị đại động mạch có sửa chữa với thông liên thất |
3 |
3 |
100 |
|
Tâm thất độc nhất |
6 |
6 |
100
|
|
Thông liên thất |
136 |
21 |
16 |
|
Kênh nhĩ thất hoặc thông liên nhĩ lỗ tiên phát |
21 |
9 |
43 |
|
Tâm nhĩ độc nhất |
– |
– |
– |
|
Thông liên nhĩ |
324 |
19 |
6 |
|
Bất thường hồi lưu tĩnh mạch phổi bán phần |
3 |
0 |
0 |
|
Bất thường hồi lưu tĩnh mạch phổi toàn phần |
6 |
1 |
17 |
|
Vị trí không xác định |
22 |
22 |
– |
|
Nguồn: Wood’s Croonian lectures |
|||
Sinh lý bệnh và di truyền học của tăng áp động mạch phổi trong hội chứng Eisenmenger
Nhiều con đường sinh học tham gia điều hòa áp lực động mạch phổi thông qua sự tác động của những yếu tố co mạch và dãn mạch [6] (Hình 5.6). Những con đường này là đối tượng có khả năng bị đột biến gen và gây ra tăng áp động mạch phổi. Trong dị tật bẩm sinh có luồng thông, có thể có dòng chảy cao và/hoặc áp lực cao. Chính áp lực cao làm tổn thương nội mạc động mạch phổi. Sang thương này khởi phát sự tăng sinh tế bào hỗn độn, chết tế bào theo chương trình, thâm nhiễm tế bào cơ trơn, xơ hóa, viêm, và phá vỡ chức năng nội mạc bình thường (có nghĩa là kích hoạt con đường đông máu, phóng thích yếu tố tăng trưởng, và làm biến đổi sự phóng thích chất hoạt mạch). Elastases nội sinh và chất nền metalloproteinase góp phần vào sự phá vỡ chất nền ngoại bào. Sự phóng thích tenascin và fibronectin khuếch đại phản ứng tăng sinh và thúc đẩy sự thâm nhiễm tế bào cơ trơn.
Về mặt giải phẫu bệnh, giai đoạn sớm của bệnh (có khả năng hồi phục) được đặc trưng bởi sự phì đại của các tiểu động mạch phổi, và lan rộng của sự cơ hóa tiểu động mạch phổi trong nang. Cuối cùng, mất giường động mạch phổi do bị tắc, mất động mạch phổi trong nang, phát triển sang thương dạng đám rối và viêm động mạch hoại tử (được xem như không hồi phục). Kháng lực mạch máu phổi tăng do sự giảm “cố định” này trong giường mạch máu phổi, kết hợp với yếu tố nhỏ về động học [7,8].
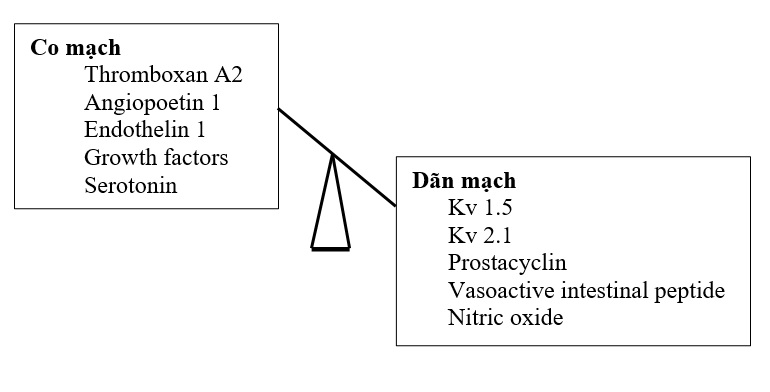
Hình 5.6: Sự cân bằng giữa co mạch và dãn mạch trong điều hòa áp lực động mạch phổi
60 – 80% trường hợp tăng áp động mạch phổi có tính gia đình, và 6% trường hợp tăng áp động mạch phổi thứ phát do dị tật tim bẩm sinh, có liên quan đến đột biến một chuỗi tế bào phôi của protein thụ thể hình thái di truyền của xương type II, nằm trên nhiễm sắc thể 2q33. Đột biến Alk 1, nằm trên nhiễm sắc thể 12q13, cũng được xác định ở tăng áp động mạch phổi vô căn và có tính gia đình [9].
Trong tăng áp động mạch phổi thứ phát, như hội chứng Eisenmenger, có đột biến TBF beta. Chẳng hạn, angiopoetin -1 [10], một yếu tố angiogenic 70-kDa, rất cần thiết cho sự phát triển mạch máu phổi, xuất hiện nhiều trong các động mạch phổi ở tăng áp động mạch phổi thứ phát. Yếu tố này làm giảm sự điều hòa đến tình trạng gần như ổn định hoàn toàn của BMPR1A, một cofactor chính cho dị nhị trùng hóa của thụ thể BMPRII. Không có dị nhị trùng hóa này, sự truyền tín hiệu SMAD xuôi dòng có thể bị tổn thương. Kết quả là sự truyền tính trạng có thể bị thất bại, như trong đột biến BMPRII tiên phát. Không ngạc nhiên khi sự có mặt angiopoetin -1 có liên quan chặt chẽ với số đo kháng lực mạch máu phổi ở bệnh nhân tăng áp động mạch phổi thứ phát.
Đánh giá tăng áp động mạch phổi trong hội chứng Eisenmenger
Hội chứng Eisenmenger là một rối loạn đa hệ thống, và việc điều trị nội khoa phải tập trung vào toàn bộ cơ thể. Bệnh ảnh hưởng đến thể chất, tinh thần, xã hội, chất lượng cuộc sống, và khả năng sinh sản. Để điều trị tốt cần phối hợp nhiều chuyên khoa (điều dưỡng chuyên khoa, phẫu thuật viên, bác sĩ chuyên khoa tim mạch, bác sĩ chuyên khoa phổi, bác sĩ gây mê, bác sĩ phụ khoa, chuyên gia kế hoạch gia đình, bác sĩ chuyên khoa huyết học, phẫu thuật viên chỉnh hình, chuyên gia tâm lý, và chuyên gia vật lý trị liệu).
Khám tổng quát
Tím, đa hồng cầu, và sung huyết kết mạc là nét đặc trưng. Khám thực thể bao gồm cả đánh giá về tình trạng mụn trứng cá – thường gặp trong hội chứng Eisenmenger. Khớp và xương dài có khuynh hướng biểu hiện phì đại khớp xương, ngón dùi trống, và gout. Lồng ngực thường gặp chứng gù vẹo sột sống, gây bệnh phổi hạn chế. Theo kinh nghiệm của chúng tôi, bệnh nhân thường có loãng xương. Bệnh sử ngưng thở do tắc nghẽn có thể làm bộc phát tăng áp động mạch phổi, vì vậy nên tìm kiếm chi tiết này. Tình trạng dinh dưỡng chung cũng nên được đánh giá.
Khám tim
Có thể phát hiện triệu chứng của dị tật bẩm sinh (ví dụ: T2 tách đôi rộng trong thông liên nhĩ). Lồng ngực trái nhô lên, mỏm tim nảy mạnh gợi ý phì đại thất phải. Hở van 3 lá có thể xảy ra muộn và đôi khi âm thổi do hở van 3 lá lớn, tần số cao do áp lực thất phải tăng. Vì độ đàn hồi của nhĩ phải bảo tồn nên sóng V có lẽ không luôn luôn là một dấu hiệu đáng tin cậy của hở van 3 lá nặng. Áp lực tĩnh mạch vẫn thấp vì cùng lý do trên cho đến giai đoạn trễ của bệnh. Có thể có âm thổi Graham – Steell của hở van động mạch phổi áp lực cao và T3 thất phải.
Cận lâm sàng chuyên biệt
Cậm lâm sàng chuyên biệt nên được sử dụng để khẳng định chẩn đoán tăng áp động mạch phổi và xác định tổn thương giải phẫu; đánh giá độ nặng của bệnh; định rõ tổn thương tim có thể phẫu thuật được không; phát hiện biến chứng của hội chứng Eisenmenger; đánh giá đáp ứng điều trị; và dự hậu.
Điện tâm đồ 12 chuyển đạo cho thấy đặc điểm của tổn thương giải phẫu, và phì đại thất phải, nhĩ phải với trục lệch phải.
Siêu âm tim 2 chiều (± siêu âm tim qua thực quản) sử dụng chất cản âm thường phát hiện được luồng thông, các tổn thương liên quan, áp lực động mạch phổi tâm thu, tâm trương. Khi không có hở van 3 lá, thời gian tăng tốc, giảm tốc [11], thời gian tiền tống máu của phổ động mạch phổi, vách liên thất dạng D, và kiểu dốc sớm của dòng chảy thì tâm trương qua van 2 lá gợi ý tăng áp động mạch phổi. Siêu âm tim còn đánh giá được chức năng cơ tim, tương tác của thất, và sự biến dạng của thất trái.
Thông tim thường không cần thiết ở bệnh nhân Eisenmenger tuổi trưởng thành, ngoại trừ:
- Bệnh nhân mới với thông tin chẩn đoán chưa hoàn chỉnh;
- Đánh giá khả năng phẫu thuật khi nghi ngờ có luồng thông trái – phải lớn;
- Bệnh tim bẩm sinh phức tạp, chẳng hạn như tâm thất độc nhất, chẩn đoán hội chứng Eisenmenger khó khăn.
Thông tim cung cấp thông tin về tính phản ứng của mạch máu ( chẳng hạn như 20-30% giảm kháng lực mạch máu phổi). Lên đến 29% bệnh nhân hội chứng Eisenmenger đáp ứng với nitric oxide, và những bệnh nhân này có tiên lượng giữa kỳ tốt hơn [12]. Bệnh nhân có luồng thông phải-trái ưu thế không có khả năng phản ứng. Nguyên lý Frick thường được áp dụng để xác định lưu lượng và kháng lực. Sai lầm quan trọng mắc phải khi ước tính sự tiêu thụ oxy và khi FiO2 > 50%. Trong tình huống sau, oxy hòa tan nên được tính cả vào kết quả tính toán huyết động. Kháng lực mạch máu phổi lớn hơn 6 đơn vị Wood sau khi dùng chất dãn mạch nên được xem là nguy cơ cao khi tiến hành phẫu thuật sửa chữa.
CT và CTPA scan cung cấp thông tin hữu ích liên quan đến bệnh lý phổi và giường mạch máu phổi (huyết khối, mạch máu tân sinh, kích thước động mạch phổi, xuất huyết, sang thương chèn ép) [13].
MRI bổ sung thông tin về chức năng và giải phẫu do siêu âm tim cung cấp, có thể gợi ý luồng thông phải-trái lúc nghỉ, khả năng phát hiện lưu lượng động mạch phổi tăng khi cho oxy 100%.
Rối loạn cầm máu
Bệnh nhân được đề cập ở trên bi giảm tiểu cầu. Bà ta có huyết khối tại chỗ trong động mạch phổi. Bệnh nhân Eisenmenger có rối loạn cầm máu đi kèm với khuynh hướng dễ tạo huyết khối. Tình trạng dễ chảy máu được dặc trưng bởi INR, prothrombin, thời gian hoạt hóa thromboplastin từng phần kéo dài, giảm số lượng tiểu cầu, và giảm chức năng tiểu cầu.
Các yếu tố đông máu phụ thuộc vitamin K, bao gồm II, VII, IX, X, và yếu tố V giảm, yếu tố von Willerbrand cũng giảm [14].Yếu tố hoạt hóa plasminogen mô tăng, thúc đẩy tình trạng kháng đông phụ thuộc protein C. Giảm tiểu cầu tương quan nghịch với độ lớn luồng thông phải-trái và có thể góp phần làm giảm sự vỡ tế bào nhân khổng lồ trong phổi khi luồng thông phải-trái tiến triển [15]. Những bất thường phóng thích tiểu cầu tương quan với chứng tăng hồng cầu thứ phát (PCV>59%) và tuổi bệnh nhân (>45 tuổi). Giảm số lượng tiểu cầu tiểu cầu và rối loạn chức năng tiểu cầu cải thiện nhanh chóng (trong vòng vài giờ) sau trích máu tĩnh mạch và cũng cải thiện khi độ bão hòa oxy trong máu tốt hơn do điều trị bệnh căn nguyên. Vì vậy, bệnh nhân mắc hội chứng Eisenmenger có nguy cơ cao ho ra máu, xuất huyết tiêu hóa, và xuất huyết liên quan đến thủ thuật như thủ thuật về răng. Khi có xuất huyết nghiêm trọng, hãy xem xét việc truyền yếu tố đông máu, desmopressin khi giảm yếu tố von Willebrand và truyền tiểu cầu.
Khuynh hướng đông máu có thể góp phần làm tổn thương nội mạc động mạch phổi [16] và kích hoạt dòng thác đông máu. D-dimer tăng theo tuổi và độ bão hòa oxy thấp hơn. Những đặc điểm này cho thấy sự tăng phá vỡ liên kết ngang của fibrinogen, ví dụ sau đông máu nội mạch. Khuynh hướng đông máu này, cùng với chứng tăng hồng cầu thứ phát và cặn trong vi tuần hoàn liên quan đến tăng độ nhớt máu, thúc đẩy sự hình thành huyết khối. Số lượng hồng cầu tăng lên làm tăng độ nhớt máu, dẫn đến sự ứ trệ tuần hoàn và tưới máu kém. Điều này thúc đẩy sự lắng đọng fibrin, huyết khối tiểu cầu trong lòng mạch, và sự tiêu thụ tiểu cầu và các yếu tố đông máu, dẫn đến đông máu nội mạch lan tỏa. Mạch máu dãn cùng vói dòng chảy chậm, như trong động mạch phổi ở hội chứng Eisenmenger, rất dễ tạo huyết khối.
Huyết khối trong động mạch phổi
Chiếm tỷ lệ lên đến 30% [17]. Bệnh nhân của chúng tôi có huyết khối lớn ở tim trái. Yếu tố nguy cơ của bà ta là lớn tuổi, giới nữ, động mạch phổi đoạn gần dãn to, tiền căn rối loạn nhịp nhĩ, và rối loạn chức năng thất.
Bệnh nhân nữ có độ bão hòa oxy thấp và tuổi >35 thuộc nhóm nguy cơ cao nhất. Gần đây, Broberg và cộng sự [18] đã chứng minh các yếu tố nguy cơ khác bao gồm: vận tốc tâm thu tối đa của động mạch phổi thấp, kích thước động mạch phổi lớn, và rối loạn chức năng thất.
Tăng hồng cầu thứ phát , thiếu sắt và nguy cơ đột quỵ
Bệnh nhân của chúng tôi trích máu tĩnh mạch tổng cộng ba lần vì có triệu chứng do tăng độ nhớt máu. Tăng hồng cầu đơn thuần gặp ở hội chứng Eisenmenger là thứ phát do sự thiếu oxy mô thúc đẩy sự phóng thích erythropoetin từ thận. Khi mức erythropoietin huyết thanh bình thường, số lượng hồng cầu thích hợp, gọi là trạng thái còn bù. Với độ bão hòa oxy trong máu động mạch hệ thống dưới 75%, rối loạn cân bằng nội môi gây ra những triệu chứng do tăng độ nhớt máu. Khi dự trữ sắt thấp (tiền căn trích máu tĩnh mạch, xuất huyết tiêu hóa, niệu dục), trong tình trạng mất bù nguy cơ tai biến mạch máu não, hoặc động mạch hoặc tĩnh mạch, tăng lên 14,7% [19]. Hồng cầu nhỏ và giảm độ đàn hồi khi di chuyển trong mao mạch được cho là nguyên nhân. Nguy cơ tai biến mạch máu não cao nhất ở bệnh nhân lớn tuổi, rối loạn nhịp và tăng huyết áp.
Trích máu tĩnh mạch thường qui ở những bệnh nhân không triệu chứng, đủ sắt, hematorite cao là không nên. Hematorite cao cần thiết cho vận chuyển oxy tốt hơn và cải thiện khả năng gắng sức [25]. Tuy nhiên, điều quan trọng là xem xét trích máu khi có triệu chứng do tăng độ nhớt máu (thường nhức đầu và tập trung kém). Khi xét chỉ định trích máu tĩnh mạch, cần tính đến hematorit và cả tình trạng sắt ( bảng 5.2). Triệu chứng tăng độ nhớt máu tương quan với hematorite cao nhưng không nhất thiết có liên quan với thiếu sắt. Khi trích một đơn vị máu tĩnh mạch, nên bù một thể tích dịch tương đương, sử dụng bộ lọc khí, cần thực hiện chậm (trên một giờ), theo dõi sát vì kháng lực mạch máu hệ thống có thể giảm đột ngột. Mức hemoglobine lý tưởng cần đạt khi trích máu cho trường hợp hạ oxy máu không được đề cập trong y văn nhưng khi có triệu chứng, trích 500ml máu thường là đủ.
Bảng 5.2: Điều trị tăng độ nhớt máu có triệu chứng
|
Triệu chứng do tăng độ nhớt máu |
Hematocrit/Sắt |
Xử trí |
|
Không |
Bất kỳ |
Không trích máu (trừ khi trước phẫu thuật) |
|
Có |
>60/đủ sắt Không mất nước |
Trích máu đồng thể tích #400ml |
|
Có |
<65/thiếu sắt |
Điều trị nguyên nhân gây thiếu sắt Không trích máu Cân nhắc sắt liều thấp |
|
Có |
>65/thiếu sắt |
Điều trị nguyên nhân gây thiếu sắt Tránh trích máu Thận trọng sắt +/- Hydroxyurea
|
Phẫu thuật ngoài tim
Bệnh nhân của chúng tôi có giai đoạn ngất trong khi chờ đợi phẫu thuật sinh thiết khối u tử cung. Những lý do có khả năng gây ra tình trạng này là mất nước, phản xạ phế vị mạch máu (vasovagal) và rối loạn nhịp.
Nhập viện để thực hiện phẫu thuật ngoài tim là khoảng thời gian đầy rủi ro cho bệnh nhân hội chứng Eisenmenger với tỷ lệ tử vong lên đến 30%. Kháng lực mạch máu hệ thống giảm có thể thúc đẩy luồng thông phải-trái, suy tuần hoàn và tử vong. Trường hợp hội chứng Eisenmenger không có luồng thông trong thất và đại động mạch (ví dụ thông liên nhĩ), việc tăng tương đối kháng lực mạch máu phổi cao hơn kháng lực mạch máu hệ thống, có thể gây ra thiếu máu cục bộ thất phải và rối loạn nhịp thất do cung cấp máu mạch vành cho thất phải bị giảm. Trái lại tăng kháng lực mạch máu hệ thống đột ngột, có thể dẫn đến suy giảm chức năng thất bởi vì kháng lực mạch máu phổi cố định vẫn còn cao, làm tăng hậu tải của thất. Bệnh nhân có rối loạn chức năng thất phải và hở van 3 lá nặng thuộc nhóm nguy cơ. Giảm oxy máu mãn tính làm giảm độ thư giãn tâm trương của thất và dự trữ cơ tim toàn bộ.
Nhịn đói trước phẫu thuật không được bù dịch đầy đủ có thể gây tình trạng mất nước, có khả năng thúc đẩy hình thành huyết khối động mạch và/hoặc tĩnh mạch. Các thuốc giảm đau trước phẫu thuật với khả năng làm giảm sự tiêu thụ oxy, có thể làm giảm kháng lực mạch máu hệ thống.
Barbiturates có khuynh hướng gây giãn mạch ngoại vi. Tuy nhiên, nói chung, tốc độ và liều thì quan trọng hơn loại thuốc dùng. Luồng thông phải-trái ít khi ảnh hưởng lên sự hấp thụ khí mê mặc dù thở khí mê kéo dài. Cơ địa dễ chảy máu của hội chứng Eisenmenger làm tăng nguy cơ xuất huyết, có thể dẫn đến giảm tiền tải và hậu tải đột ngột, thúc đẩy suy tuần hoàn. Gây tê tủy sống và ngoài màng cứng dù được áp dụng thành công trong những thủ thuật nhỏ và ngắn, cũng có khả năng làm giảm tiền tải và hậu tải. Rối loạn nhịp quanh phẫu thuật có thể gây rối loạn huyết động.
Trong giai đoạn hậu phẫu, bệnh nhân có nguy cơ bị huyết khối tĩnh mạch và thuyên tắc do huyết khối. Vào những ngày đầu hậu phẫu, hạ huyết áp tư thế có thể làm giảm kháng lực mạch máu hệ thống. Cần giảm đau tốt trong giai đoạn hậu phẫu nhằm tránh phản ứng giao cảm quá mức, nhưng cẩn thận để tránh giảm đột ngột kháng lực mạch máu hệ thống.
Các biện pháp sau có thể giúp giảm nguy cơ phẫu thuật ngoài tim ở bệnh nhân mắc hội chứng Eisenmenger:
- Đánh giá tiền phẫu cẩn thận (bệnh sử, thăm khám, ECG, X-Quang, CT Scan, huyết đồ, bilan đông máu, sinh hóa máu, siêu âm tim). Lợi ích-nguy cơ của phẫu thuật ngoài tim nên được đánh giá bởi những thành viên có kinh nghiệm nhất của ê kíp.
- Trích máu tĩnh mạch tiền phẫu có thể được xem xét nếu hematocrit > 65%. Trích máu thường làm giảm tiểu cầu và có thể làm tăng tương đối cung lượng tim.
- Bộ lọc khí nên sử dụng ở đường truyền tĩnh mạch để tránh thuyên tắc khí.
- Dịch truyền tĩnh mạch nên được chỉ định khi bệnh nhân đói. Thông thường chúng tôi sẽ bắt đầu truyền dịch lúc nửa đêm trước ngày dự kiến phẫu thuật.
- Vào giai đoạn tiền phẫu, phẫu thuật viên và bác sĩ gây mê tim mạch có kinh nghiệm nhất nên xây dựng kế hoạch chăm sóc chu phẫu cho bệnh nhân.
- Phẫu thuật nên tiến hành trong thời gian càng ngắn, càng ít biến chứng càng tốt, tránh xuất huyết. Những thay đổi về huyết động nên được phát hiện và điều trị sớm. Cần theo dõi sát huyết áp động mạch và áp lực tĩnh mạch trung tâm trong lúc phẫu thuật, độ bão hòa oxy trước và sau ống. Theo dõi áp lực động mạch phổi trực tiếp thường không cần thiết vì hầu hết bệnh nhân hội chứng Eisenmengers có luồng thông không hạn chế giữa tuần hoàn phổi và hệ thống, đòi hỏi áp lực động mạch phổi và hệ thống tương đương. Nên dùng thuốc mê ít làm thay đổi trương lực mạch máu. Chúng tôi thích vô cảm tim mạch với benzodiazepine /opiate vì nó trung tính nhất, chú ý kiểm soát tiền tải bằng truyền dịch và kiểm soát kháng lực mạch máu hệ thống bằng phenylephrine.
- Phenyleprine có thể hữu ích trong điều trị dãn mạch hệ thống.mặc dù sự kết hợp thuốc trợ apha và trợ beta cũng có thể xem xét.
- Xuất huyết có thể đáp ứng với truyền tiểu cầu, các yếu tố đông máu phụ thuộc vitamin K, và, khi có hội chứng von-Willebrand mắc phải, sử dụng desmo-pressin.
- Dự phòng huyết khối tĩnh mạch sâu sau phẫu thuật với vớ đàn hồi, dụng cụ đè ép tĩnh mạch bằng hơi và heparin khi nguy cơ xuất huyết đã được đánh giá.
- Vô cảm toàn thân thông thường được dùng hơn vô cảm ngoài màng cứng và/hoặc tủy sống.
- Vô cảm tại chỗ nên dùng bất cứ khi nào có thể.
- Điều trị giảm đau thích hợp là quan trọng nhưng không được làm giảm kháng lực mạch máu hệ thống.
- Khi cần thông khí cơ học trong giai đoạn hậu phẫu, tương tác tuần hoàn-hô hấp cần được đánh giá chính xác. Liệt cơ và thông khí áp lực dương ngắt quãng (IPPV) thường dùng để tránh vô cảm sâu và cử động phản xạ đáp ứng với đau, nó cũng giúp kiểm soát carbon-dioxide và giảm oxy máu tốt hơn. Chế độ thở máy nên giữ gần hoặc vừa trên mức dung tích khí cặn chức năng.
Rối loạn chức năng thận
Bệnh nhân của chúng tôi cũng có suy thận mãn do viêm cầu thận tăng sinh màng. Mặc dù điều này phản ánh nguyên nhân gây bệnh thận cho bà ta không phải là hội chứng Eisenmenger, nhưng những đặc điểm mô học của bệnh thận trong hội chứng Eisenmenger chưa được định nghĩa rõ. Rối loạn chức năng thận thường hiện diện ở thời điểm chẩn đoán hội chứng Eisenmenger. Thực vậy, ở những bệnh nhân tím, ít nhất 30% có rối loạn chức năng thận đặc biệt ở những người có thời gian tím dài hơn và hematorit cao hơn [20]. Bệnh thận ở hội chứng Eisenmenger biểu hiện proteine niệu và độ lọc cầu thận giảm. Cơ chế có thể là do tăng độ nhớt máu và thuyên tắc vi mạch. Tăng độ nhớt máu do tăng số lượng hồng cầu có thể làm tăng sự tân tạo mạch máu trong gường mao mạch cầu thận gây phì đại cầu thận. Nguyên mẫu tiểu cầu di chuyển vào tuần hoàn động mạch không bị vỡ ra ở phổi khi đi qua được ghi nhận có mặt ở cầu thận [21]. Bệnh cầu thận có lẽ là sang thương nổi bật mặc dù rối loạn chức năng ống thận cũng hiện diện. Những rối loạn này bao gồm toan hóa ống thận gần và ống thận xa [22]. Bên cạnh đó, cũng có sự suy yếu của cơ chế bù trừ để đáp ứng với lưu lượng huyết tương tới thận bị giảm do tăng lọc, làm tiến triển bệnh thận. Thuốc ức chế men chuyển có lợi trong việc giảm bài tiết protein nhưng không có lợi trên những thông số khác của thận [20]. Liệu pháp steroid thành công trong một số trường hợp. Tăng acid uric phản ánh sự giảm độ lọc cầu thận vì sự bài tiết acid uric bị giảm. Acid uric tăng là yếu tố nguy cơ tiên lượng xấu ở bệnh nhân Eisenmenger.
Thiếu máu cục bộ cơ tim
Bệnh nhân của chúng tôi có đau thắt ngực từng cơn, đặc biệt khi gắng sức hoặc lúc nhịp nhanh. Thiếu máu cục bộ thất phải trong tăng áp động mạch phổi được thấy rõ. Lưu lượng động mạch vành phải được điều hòa tốt nhất khi có dòng chảy ở cả hai thì tâm thu và tâm trương và khi áp lực động mạch phổi thấp. Trong tăng áp động mạch phổi, thất phải hoạt động ở mức áp lực hệ thống làm lượng mạch máu trong động mạch vành phải ưu thế trong thì tâm trương. Khi áp lực động mạch phổi cao, sự tự điều hòa dòng chảy mạch vành không thể thực hiện được trong thì tâm thu. Áp lực cuối tâm trương thất phải tăng, thể tích nhát bóp thất phải giảm, và cung lượng tim giảm, áp lực động mạch chủ giảm và vì vậy làm giảm thêm áp lực tưới máu mạch vành. Vì vậy, bệnh nhân đi vào vòng xoắn mất bù, kết thúc với rối loạn nhịp thất và suy tuần hoàn. Những quan sát này cho thấy cần chú ý đến tầm quan trọng của việc duy trì tốt huyết áp động mạch hệ thống, nên dùng thuốc dãn mạch phổi chọn lọc và điều trị tốt những biến cố làm tăng nhu cầu oxy cơ tim cấp tính, ví dụ như rối loạn nhịp.
Gần đây, sự chèn ép động mạch vành trái bởi thân động mạch phổi hoặc đoạn đầu động mạch phổi phải được xem như là một cơ chế góp phần làm suy động mạch vành [23]. Thất phải lớn đẩy lệch thất trái về phía mỏm hơn và làm tim xoay ngược kim đồng hồ so với động mạch chủ. Điều này kết hợp với động mạch phổi phình làm chèn ép lỗ xuất phát động mạch vành trái và gây thiếu máu cục bộ cơ tim. Chèn ép lỗ xuất phát động mạch vành trái có thể được điều trị thành công bằng cách đặt stent động mạch vành trong khi chờ đợi ghép tim phổi. Những triệu chứng ở bệnh nhân của chúng tôi cải thiện rõ khi sildenafil được bắt đầu.
Ngừa thai
Bởi vì nguy cơ tử vong cao (lên đến 30%) do thai kỳ ở hội chứng Eisenmenger và tăng áp động mạch phổi có liên quan với bệnh tim bẩm sinh, ngừa thai hiệu quả là bắt buộc [24]. Lựa chọn phương pháp ngừa thai nên được quan tâm không chỉ vì tăng áp động mạch phổi mà còn vì luồng thông phải – trái (nguy cơ thuyên tắc nghịch thường), tiền căn huyết khối, kể cả huyết khối tại chỗ trong động mạch phổi, rung nhĩ, tiền căn viêm nội tâm mạc nhiễm trùng, rối loạn chức năng thất và điều trị thuốc có thể ảnh hưởng đến quyết định lựa chọn phương pháp ngừa thai và ngược lại. Nói chung thuốc ngừa thai chứa estrogens (viên ngừa thai uống kết hợp) bị chống chỉ định vì nguy cơ tạo huyết khối ở cả động mạch và tĩnh mạch, và phương pháp ngăn tinh trùng qua cổ tử cung đơn độc không mang lại tỷ lệ thành công cao. Progesterone đơn thuần được khuyến cáo nên dùng.
Phương pháp này bao gồm:
- Viên chỉ chứa progesterone (Cerazette), có cửa sổ an toàn 12 giờ nếu quên uống; Cerazette có thể ảnh hưởng đến INR, do đó cần kiểm tra INR thường xuyên khi bắt đầu dùng. Progestogens có thể gây giữ nước và vì vậy cần theo dõi sát hơn nếu bệnh nhân có suy tim sung huyết. Những thuốc chuyển hóa qua gan (Bosentan, kháng sinh) làm giảm hiệu quả của thuốc, vì vậy cần sử dụng thêm các biện pháp tránh thai khác.
- Tiêm Depo-Provera tốt nhất là mỗi 12 tuần, có hiệu quả cao tương tự như triệt sản. Tuy nhiên, khi dùng Coumadin có nhiều nguy cơ tạo khối máu tụ. Nhiều phụ nữ bị vô kinh với depo-provera và đây là lợi điểm khi dùng kháng đông. Với tất cả những phương pháp dựa trên progesterone, thận trọng khi có suy tim sung huyết và khi dùng thuốc chuyển hóa qua gan.
- Implanon (cấy dưới da) có hiệu quả cao, tương tự triệt sản. Nó có thể được cấy với vô cảm tại chỗ và ngừa thai được 3 năm; sau đó cần cấy lại. Sự hình thành khối máu tụ không phải là vấn đề đáng quan tâm. Khoảng 20% phụ nữ vô kinh. Phương pháp này lý tưởng cho phụ nữ bị hội chứng Eisenmenger.
- Mirena có thể cấy ở phụ nữ chưa sanh đẻ và có hiệu quả ngừa thai cao. Tuy nhiên việc cấy có nguy cơ gây ngất do phản xạ phế vị mạch máu (vasovagal) ở 5% trường hợp, có thể gây tử vong ở bệnh nhân hội chứng Eisenmenger. Nó cũng có thể gây viêm nội tâm mạc nhiễm trùng dù nguy cơ thấp. Vì những lý do nêu trên, Mirena không phải là lựa chọn hàng đầu ở phụ nữ bị hội chứng Eisenmenger, mặc dù có thể cần thiết ở một số ca chọn lọc.
Triệt sản gây ra vài bất lợi ở phụ nữ bị hội chứng Eisenmenger. Phương pháp này cần phẫu thuật, qua soi ổ bụng nhỏ, và có tỷ lệ thất bại muộn đặc biệt ở phụ nữ trẻ. Thai ngoài tử cung có thể xảy ra ở phụ nữ đã triệt sản và điều này gây rắc rối cho phụ nữ bị hội chứng Eisenmenger đang dùng kháng đông. Tuy nhiên, thỉnh thoảng phương pháp này là lựa chọn duy nhất và nó có thể được thực hiện tương đối an toàn bằng cách sử dụng kết hợp gây tê tủy sống-ngoài màng cứng liều thấp, và thể tích CO2 thấp (< 200cc). Cần theo dõi sát bệnh nhân bởi ê kíp có kinh nghiệm. Gần đây, triệt sản qua nội soi tử cung, sử dụng dụng cụ Essure, đã được áp dụng thành công và tránh được các vấn đề liên quan đến phẫu thuật triệt sản [25].
Tóm lại phương pháp ngừa thai bằng progesterone là phương pháp ngừa thai được lựa chọn ở bệnh nhân bị hội chứng Eisenmenger. Cấy dưới da có nhiều ưu điểm, làm cho nó trở thành một phương pháp lý tưởng nhất. Các phương pháp có thể dùng được bao gồm viên progesterone đơn thuần (Cerazette) và Depo-Provera.
Điều trị hội chứng Eisenmenger
Nguyên tắc chung
Bệnh nhân bị hội chứng Eisenmenger nên được đánh giá và theo dõi ở trung tâm tim bẩm sinh người lớn có các chuyên gia về tăng áp lực động mạch phổi, hoặc có liên kết với một trung tâm như thế. Đánh giá tổng quát và chuyên biệt bệnh nhân hội chứng Eisenmenger đã được thảo luận ở trên.
Bệnh nhân nên được khuyên những điều sau đây:
- Hoạt động thể lực: tránh hoạt động quá sức
- Tránh bị mất nước
- Những triệu chứng của viêm nội tâm mạc nhiễm trùng và áp xe não để bệnh nhân có thể giúp phát hiện và điều trị sớm
- Thai kỳ và ngừa thai cần được thảo luận chi tiết. Vấn đề kinh nguyệt có lẽ cần đánh giá thêm.
- Tránh hút thuốc lá và thuốc kích thích
- Đi máy bay : áp lực trong khoang máy bay được duy trì ở mức tương đương 2000m. Đa số bệnh nhân bị hội chứng Eisenmenger dung nạp tốt ở mức này. Dự phòng huyết khối tĩnh mạch sâu bao gồm tránh mất nước, mang vớ chân đàn hồi và tránh bất động kéo dài.
- Lợi ích của việc tiêm ngừa vaccine influenza và pneumovax hàng năm.
Đánh giá thêm
Oxy tại nhà
Nhiều nghiên cứu trước đây đã chứng minh những lợi ích sống còn ở trẻ em mắc hội chứng Eisenmenger. Tuy nhiên, điều này không được chứng minh ở người lớn vào giai đoạn bệnh tiến triển. Theo kinh nghiệm của chúng tôi, vài bệnh nhân cải thiện triệu chứng với thở oxy tại nhà, mặc dù việc sử dụng bắt buộc oxy tại nhà cho luồng thông phải-trái còn đang bàn cãi. Oxygen làm tăng độ bão hòa hemoglobin trong máu động mạch ở vài bệnh nhân hội chứng Eisenmenger người lớn, có lẽ thông qua hiệu quả dãn mạch phổi qua trung gian oxy [26].
Kháng đông
Vì cùng tồn tại khuynh hướng xuất huyết cũng như tạo huyết khối nên kháng đông được khuyên không sử dụng thường qui. Ở bệnh nhân có huyết khối động mạch phổi tại chỗ, cần cân nhắc khi sử dụng kháng đông vì nguy cơ vỡ động mạch phổi và xuất huyết cũng như xuất huyết từ vùng nhồi máu động mạch phổi đoạn xa.
Tăng hồng cầu
Duy trì tình trạng tăng hồng cầu thứ phát ổn định, còn bù, đủ sắt là điều cơ bản để đảm bảo cung cấp đủ oxy, phòng ngừa đột quị và những triệu chứng do tăng độ nhớt máu.
Ghép tim phổi
Trái với tăng áp động mạch phổi vô căn, tỷ lệ sống còn tự nhiên của những bệnh nhân bị hội chứng Eisenmenger thường tốt hơn tỷ lệ sống còn ở bệnh nhân ghép tim-phổi (73% lúc 1 năm, 51% lúc 5 năm và 28% lúc 10 năm) [27]. Điều này có nghĩa là việc ghép tim-phổi trong thực hành lâm sàng là một quyết định phức tạp. Những bệnh nhân có triệu chứng nặng và chất lượng cuộc sống kém (phân độ chức năng kém, suy tim sung huyết độ bão hòa oxy thấp, khởi phát rối loạn nhĩ và thất, bệnh nhân bắt đầu có dấu hiệu tổn thương thận) nên được xem xét.
Điều trị bệnh gốc
Prostacyclin và các dẫn xuất
Prostacyclin có hiệu quả tốt trong tăng áp động mạch phổi vô căn với cải thiện sống còn, cải thiện phân độ chức năng và chất lượng cuộc sống. Trong hội chứng Eisenmenger hiệu quả của nó được cho thấy qua 2 nghiên cứu đoàn hệ mở (open-label), nhỏ [28,29]. Prostacyclin cải thiện phân độ chức năng lên đến 80%, cải thiện độ bão hòa oxy trong máu động mạch 0 -16%, giảm kháng lực mạch máu phổi khoảng 50%, cải thiện khoảng cách đi bộ 6 phút. Liều của Prostacyclin được dùng trong những nghiên cứu này là 14 ng/kg/ph và 82ng/kg/ph. Prostacyclin bị hạn chế bởi cách sử dụng truyền tĩnh mạch và tác dụng phụ (đau hàm, nhức đầu, tiêu chảy, buồn nôn, nổi mẫn đỏ, đau chi, bất lực, sụt cân, nhiễm trùng huyết khối-thuyên tắc, tụt huyết áp, báng bụng, trộm máu mạch vành, phản ứng dội khi ngưng truyền và giảm tiểu cầu). Những hạn chế này đã thôi thúc tiến hành nhiều nghiên cứu quan trọng về các đường đưa thuốc vào cơ thể của Prostacyclin và các dẫn xuất của nó. Những chất này bao gồm Treprostinil tiêm dưới da, Beraprost uống, Iloprost và Treprostinil phun khí dung, UT 15-C uống. Những báo cáo hiện tại về những thuốc này trong hội chứng Eisenmenger còn hạn chế trừ một số ít trường hợp chứng minh có lợi.
Ức chế thụ thể Endothelin
Bosentan là một đối kháng thụ thể endothelin kép làm giảm kháng lực động mạch phổi, mức độ xơ hóa và viêm trong phổi. Bosentan có hiệu qủa trong hội chứng Eisenmenger. Nó cải thiện phân độ chức năng (57-100% cải thiện ít nhất một phân độ) [30,31]. Độ bão hòa oxy trong máu động mạch cải thiện khoảng 5%, 0% và 11%. Kháng lực mạch máu phổi giảm ở thời điểm 16 tuần khoảng 9%, so với 5% xấu đi trong nhóm giả dược. Khoảng cách đi bộ 6 phút cải thiện khoảng 13% (43 phút ± 8phút) ở cùng thời điểm. Một bệnh nhân có tác dụng phụ quan trọng cần ngưng điều trị. Hai bệnh nhân (5,5%) ngưng điều trị do men gan tăng. Lợi ích sống còn lâu dài cần đánh giá thêm. Đối kháng thụ thể endotheline khác là Sitaxsentan, ức chế thụ thể endotheline A chọn lọc. Hiện tại không có dữ liệu về việc sử dụng thuốc này trong hội chứng Eisenmenger.
Ức chế phosphodiesterase
Ức chế phosphodiesterase type 5 đã chứng minh được hiệu quả trong điều trị tăng áp động mạch phổi vô căn. Thuốc được biết đến nhiều nhất trong nhóm này là sildenafil. Những thuốc khác bao gồm Tadalafil (thời gian bán hủy dài hơn) và Vardenafil. Một số nhỏ những nghiên cứu mở (open-label) nhắm vào hiệu quả trên huyết động cấp tính và dự hậu xa hơn cho thấy không chỉ an toàn mà còn hiệu quả trong sự điều chỉnh bilan huyết động của hội chứng Eisenmenger. Độ bão hòa oxy cải thiện 10% lúc 6 tháng, 7% lúc 19 tháng, và 5% lúc 3 tháng. Kháng lực mạch máu phổi giảm 50% lúc 6 tháng, 30% lúc 3 tháng, và 43% lúc 19 tháng [32,34]. Kháng lực mạch máu hệ thống không thay đổi trừ khi dùng liều sidenafil cao hơn( 276mg/ngày). Điều này có liên quan với việc tăng đáng kể cung lượng tim (2,9 – 3,7L /phút/m2). Hiện không có nhiều thử nghiệm ngẫu nhiên kiểm chứng giả dược xác nhận hiệu quả của nó. Những dữ liệu gần đây hơn chứng minh rằng ức chế phosphodiesterase có thể kích thích co bóp thất phải phì đại [35].
Chiến lược điều trị tương lai
Những thuốc trong tương lai có khả năng tác động một số con đường được đề cập ở trên giúp điều hòa những tín hiệu nội bào, xâm nhiễm tế bào cơ trơn, và protein thụ thể gắn kết ở màng, kể cả kênh Kv.
Ca lâm sàng
Bệnh nhân chúng tôi được bắt đầu sildenafil 20mg, 3 lần/ngày, liệu pháp oxygen tại nhà, điều trị suy tim tích cực. Các biện pháp này giúp cải thiện phân độ chức năng và chất lượng cuộc sống.
Tài liệu tham khảo
- Barst RJ, McGoon M, Torbicki A, et al. Diagnosis and differential assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2004;43:40S–47S.4 Adult Congenital Heart Dis
- Diller GP, Dimopoulos K, Broberg CS, et al. Presentation, survival prospects, and predictors of death in Eisenmenger syndrome: a combined retrospective and casecontrol study. Eur Heart J 2006;27:1737–42.
- Cantor WJ, Harrison DA, Moussadji JS, et al. Determinants of survival and length of survival in adults with Eisenmenger syndrome. Am J Cardiol 1999;84:677–81.
- Daliento L, Rebellato L, Angelini A, et al. Fatal outcome in Eisenmenger syndrome. Cardiovasc Pathol 2002;11:221–8.
- Wood P. The Eisenmenger syndrome or pulmonary hypertension with reversed central shunt. Br Med J 1958;2:755–62.
- Humbert M, Morrell NW, Archer SL, et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J Am Coll Cardiol 2004;43:13S–24S.
- Heath D, Edwards JE. The pathology of hypertensive pulmonary vascular disease; a description of six grades of structural changes in the pulmonary arteries with special reference to congenital cardiac septal defects. Circulation 1958;18: 533–47.
- Rabinovitch M, Haworth SG, Castaneda AR, Nadas AS, Reid LM. Lung biopsy in congenital heart disease: a morphometric approach to pulmonary vascular disease. Circulation 1978;58:1107–22.
- Roberts KE, McElroy JJ, Wong WP, et al. BMPR2 mutations in pulmonary arterial hypertension with congenital heart disease. Eur Respir J 2004;24:371–4.
- Du L, Sullivan CC, Chu D, et al. Signaling molecules in nonfamilial pulmonary hypertension.N Engl J Med 2003;348:500–9.
- Mirrakhimov MM, Tenenbaum AM, Moldotashev IK, Niazova ZA, Zlatkovsky ML. Newapproaches to noninvasive assessment of pulmonary artery pressure. Clin Cardiol 1992;15:811–16.
- Post MC, Janssens S, Van de Werf F, Budts W. Responsiveness to inhaled nitric oxide is a predictor for mid-term survival in adult patients with congenital heart defects and pulmonary arterial hypertension. Eur Heart J 2004;25:1651–6.
- Sheehan R, Perloff JK, Fishbein MC, et al. Pulmonary neovascularity: a distinctive radiographic finding in Eisenmenger syndrome. Circulation 2005;112:2778–85.
- Henriksson P, Varendh G, Lundstrom NR. Haemostatic defects in cyanotic congenital heart disease. Br Heart J 1979;41:23–7.
- Lill MC, Perloff JK, Child JS. Pathogenesis of thrombocytopenia in cyanotic congenital heart disease. Am J Cardiol 2006;98:254–8.
- Oechslin E, KiowskiW, Schindler R, et al. Systemic endothelial dysfunction in adults with cyanotic congenital heart disease. Circulation 2005;112:1106–12.
- Perloff JK, Hart EM, Greaves SM, et al. Proximal pulmonary arterial and intrapulmonary radiologic features of Eisenmenger syndrome and primary pulmonary hypertension. Am J Cardiol 2003;92:182–7.
- Broberg CS, Ujita M, Prasad S, et al. Pulmonary arterial thrombosis in eisenmenger syndrome is associated with biventricular dysfunction and decreased pulmonaryflow velocity. J Am Coll Cardiol 2007;50:634–42.
- Ammash N,Warnes CA. Cerebrovascular events in adult patients with cyanotic congenital heart disease. J Am Coll Cardiol 1996;28:768–72.
- Fujimoto Y, Matsushima M, Tsuzuki K, et al. Nephropathy of cyanotic congenital heart disease: clinical characteristics and effectiveness of an angiotensin-converting enzyme inhibitor. Clin Nephrol 2002;58:95–102.pter 5 Pulmonary arterial hypertension i
- Perloff JK, Latta H, Barsotti P. Pathogenesis of the glomerular abnormality in cyanotic congenital heart disease. Am J Cardiol 2000;86:1198–204.
- Vida VL, Mack R, Barnoya J, et al. The association of renal tubular acidosis and cyanotic congenital heart disease.J Thorac Cardiovasc Surg 2005;130:1466–7.
- Guerin P, Warin-Fresse K, Crochet D. Kinking of the main stem of the left coronary artery in the setting of Eisenmenger syndrome: an unusual cause of angina pectoris. Cardiol Young 2007:1–3.
- Thorne S, Nelson-Piercy C, MacGregor A, et al. Pregnancy and contraception in heart disease and pulmonary arterial hypertension. J Fam Plann Reprod Health Care 2006;32:75–81.
- FamuyideAO,HopkinsMR,El-Nashar SA, et al. Hysteroscopic sterilization inwomen with severe cardiac disease: experience at a tertiary center. Mayo Clin Proc 2008;83: 431–8.
- Walker F, Mullen MJ, Woods SJ, Webb GD. Acute effects of 40% oxygen supplementation in adults with cyanotic congenital heart disease. Heart (Br Cardiac Soc) 2004;90:1073–4.
- Stoica SC, McNeil KD, Perreas K, et al. Heart-lung transplantation for Eisenmenger syndrome: early and long-term results. Ann Thorac Surg 2001;72:1887–91.
- Fernandes SM, Newburger JW, Lang P, et al. Usefulness of epoprostenol therapy in the severely ill adolescent/adult with Eisenmenger physiology. Am J Cardiol 2003;91: 632–5.
- Rosenzweig EB, Kerstein D, Barst RJ. Long-term prostacyclin for pulmonary hypertension with associated congenital heart defects. Circulation 1999;99:1858–65.
- Christensen DD, McConnell ME, Book WM, MahleWT. Initial experience with bosentan herapy in patients with the Eisenmenger syndrome. Am J Cardiol 2004;94:261–3.
- Kotlyar E, Sy R, Keogh AM, et al. Bosentan for the treatment of pulmonary arterial hypertension associated with congenital cardiac disease. Cardiol Young 2006;16: 268–74.
- Chau EM, Fan KY, Chow WH. Effects of chronic sildenafil in patients with Eisenmenger syndrome versus idiopathic pulmonary arterial hypertension. Int J Cardiol 2007;120:301–5.
- Garg N, Sharma MK, Sinha N. Role of oral sildenafil in severe pulmonary arterial hypertension: clinical efficacy and dose response relationship. Int J Cardiol 2007;120:306–13.
- Mukhopadhyay S, Sharma M, Ramakrishnan S, et al. Phosphodiesterase-5 inhibitor in Eisenmenger syndrome: a preliminary observational study. Circulation 2006;114:1807– 10.
- Nagendran J, Archer SL, Soliman D, et al. Phosphodiesterase type 5 is highly expressed in the hypertrophied human right ventricle, and acute inhibition of phosphodiesterase type 5 improves contractility. Circulation 2007;116:238–48.

Để lại bình luận
Bạn cần phải đăng nhập để đăng bình luận.