(Left Ventricular Outflow Tract Obstruction)
Tác giả: Craig S. Broberg
Người dịch: BS Nguyễn Thị Thanh Châu
DANH MỤC CHỮ VIẾT TẮT
- Ao: Aorta
- BAV: Bicuspic aortic valve
- ECG: Electrocardiogram
- LA: Left atrium
- LV: Left ventricle
- LVOT: Left ventricular outflow tract
- SAS: Subaortic stenosis
- ĐMC: Động mạch chủ
Một phụ nữ 24 tuổi khi được sinh ra đã bị hẹp eo động mạch chủ , van động mạch chủ hai mảnh và hẹp phần cơ dưới van động mạch chủ. Lúc 4 tháng tuổi, cô ta đã được sửa hẹp eo động mạch chủ với phẫu thuật nối mạch máu tận – tận. Lúc 3 tuổi, cô ta được phẫu thuật cắt bỏ dải xơ dưới van và cơ vách liên thất. Hẹp tồn lưu vẫn hiện diện, vì vậy lúc 5 tuổi, cô ấy đã trải qua phẫu thuật mở rộng tại gốc động mạch chủ với thay van động mạch chủ nhân tạo ( St. Jude 19mm) cũng như cắt thêm phần cơ ở xa hơn và mở rộng đường thoát thất trái (LVOT) bằng miếng vá . Có một lỗ thủng nhỏ trên lá trước van hai lá xảy ra vào thời điểm này.
Cô ta tiếp tục được theo dõi đều đặn với bác sĩ tim mạch nhi khoa và vẫn không có triệu chứng. Siêu âm tim của cô ta cho thấy vận tốc là 4.1 m/s qua đường thoát thất trái . Cô ấy được khuyên tránh các hoạt động gắng sức, nhưng không có một can thiệp nào nhằm làm giảm thiểu những triệu chứng và những phẫu thuật trước đó của cô ta. Độ chênh áp ngang van vẫn ổn định trong nhiều năm. Cô ấy hoàn thành xong chương trình trung học và vào học cao đẳng, mặc dù vậy cô ấy cảm thấy khó khăn tăng dần trong các hoạt động thể lực .
Cô ta bị tái phát sau khi học xong cao đẳng. Huyết áp của cô ấy là 105/68 mmHg, mạch 86 nhịp/phút. Cô ấy gầy và thấp hơn so với tuổi của mình, nhưng trông khỏe mạnh. Mạch tĩnh mạch cảnh của cô ấy tăng nhẹ. Âm thổi tâm thu 3/6 nghe rõ nhất ở bên trái phía trên của xương ức, lan lên cổ, cũng như âm thổi toàn tâm thu ở mỏm tim. Mỏm tim lệch nhẹ sang bên. Mạch ngoại biên giảm nhẹ. Điện tâm đồ của cô ta cho thấy nhịp xoang, có phì đại thất trái và thỉnh thoảng có nhịp thất đến sớm. Trên điện tâm đồ 24 giờ ghi nhận có chuỗi gồm 5 nhịp nhanh thất. Dấu hiệu trên siêu âm tim gồm có phì đại trung bình thất trái nhưng chức năng tâm thu bình thường, hở van hai lá mức độ trung bình, vận tốc qua đường thoát thất trái là 4.8 m/s với độ chênh áp trung bình là 54 mmHg. Điều này được xác nhận bằng thông tim; với độ chênh áp dưới van động mạch chủ là 15 mmHg, ngang van là 35 mmHg và thêm vào đó chênh áp qua đoạn hẹp eo động mạch chủ là 10 mmHg. Áp lực cuối tâm trương thất trái là 24 mmHg. Cô ấy đã được xem xét khi khám, theo dõi, thảo luận về tính thích hợp, thời điểm và dạng can thiệp.
TỔNG QUAN
Tắc nghẽn đường thoát thất trái không lành tính. Sự tác động qua lại của một phức hợp bình thường giữa đường thoát thất trái, van ĐMC và gốc ĐMC được mô tả như một khối, kết hợp trong một hệ thống [1]. Do mỗi bộ phận cấu thành phải làm việc trong sự hài hòa, có sự phá vỡ hay thay đổi của yếu tố nào đó có thể gây hậu quả cho cả khối. Mặc dù có khoảng rộng cho những tồn lưu mức độ nặng, nhiều dạng tắc nghẽn đường thoát thất trái có thể gây ra những tình huống khó xử ở một thời điểm nào đó đối với bác sĩ và bệnh nhân, do bởi tần suất cao những khiếm khuyết cùng tồn tại, sự cần thiết của nhiều cuộc phẫu thuật, và khả năng chịu đựng áp lực trên thất trái trong thời gian dài như trường hợp kể trên. Không một bệnh nhân nào có tắc nghẽn đường thoát thất trái mà không theo dõi lâm sàng đều đặn ở một bác sĩ có kinh nghiệm. Ngay cả với việc ngưng theo dõi, những ảnh hưởng đáng kể đến cuộc sống và kết cục của bệnh nhân, những quyết định về mặt lâm sàng có thể khó thực hiện.
Chuyên đề về tắc nghẽn đường thoát thất trái bao gồm nhiều bất thường bẩm sinh có thể được xem xét cùng nhau, do bởi ảnh hưởng về mặt huyết động của những bất thường này bao trùm nhau và thường cùng tồn tại. Tắc nghẽn có thể tại van, dưới van hoặc trên van sắp xếp theo thứ tự tần suất giảm dần. Mặc dù điều tệ hại nhất về mặt huyết động ở mỗi trường hợp tương tự nhau, nhưng tình trạng đặc biệt của các dạng tắc nghẽn khác nhau đáng được xem xét và hiểu biết một cách riêng biệt. Tắc nghẽn dòng chảy về mặt động lực học do dày lệch tâm vách thất có thể gây ra biến chứng tắc nghẽn đường thoát thất trái bất kỳ dạng nào, nhưng nếu điều này xảy ra trong bệnh cảnh của bệnh cơ tim phì đại cần được thảo luận riêng và không bao gồm ở đây.
Dấu hiệu và triệu chứng của bất kỳ dạng sang thương hẹp đường thoát thất trái nào cũng giống với hẹp van ĐMC mắc phải. Những dấu hiệu thăm khám thực thể điển hình đã được tóm tắt gần đây [2] và phụ thuộc vào độ nặng của tắc nghẽn. Nghe tim có thể phát hiện tiếng phụt tâm thu đơn thuần – một dạng của âm thổi hoặc âm phụt tâm thu mạnh có rung miu. Diện đập của mỏm tim có thể ở vị trí bình thường hoặc lệch vị trí. Mạch ngoại biên nảy nhẹ nếu hẹp nặng. Điện tim (ECG) có thể bình thường hoặc có hình ảnh dày thất trái do tăng áp lực. Van ĐMC hai mảnh (BAV) thường tạo ra tiếng “Click” phụt tâm thu xảy ra từ sự hạn chế của lá van khi mở (Hình 7.1)
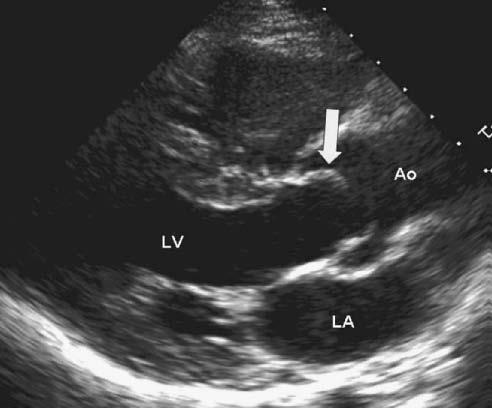
Hình 7.1 :Siêu âm tim qua thành ngực ở mặt cắt cạnh ức trục dọc của một bệnh nhân có van ĐMC hai mảnh chức năng bình thường. Trong thì tâm thu, lá van mở hạn chế do kích thước lá van, lá van dạng vòm và tạo ra tiếng click phụt tâm thu nghe rõ. Dấu hiệu này rất điển hình của van ĐMC hai mảnh (BAV-Bicuppbid Aortic Valve) LA: Left Ventricle, LA: Left atrium, Ao: Aorta)
Khi có tắc nghẽn đáng kể xảy ra, về mặt lý thuyết sẽ có nguy cơ ngất liên quan với gắng sức nếu cung lượng tim không thể tăng kịp với nhu cầu chuyển hóa. Vì vậy đa số người bệnh sẽ được khuyến cáo tránh hoạt động thể lực gắng sức khi có hẹp ở mức độ trung bình hay nặng. Tuy nhiên, ngay cả hoạt động thể lực gắng sức cũng không chắc có làm thay đổi diễn tiến tự nhiên của bệnh ở bệnh nhân hay không [3] .
Những sang thương tắc nghẽn trong thai kì không được dung nap tốt như những sang thương hở van [4], và vì vậy những bệnh nhân có tắc nghẽn đường thoát thất trái sẽ được đánh giá cẩn thận trước khi dự định mang thai, lý tưởng là trắc nghiệm gắng sức tim phổi. Bất kỳ bệnh nhân nào khi mang thai có hẹp đường thoát thất trái với bất kỳ dạng nào cần được gửi tới trung tâm tim mạch và sản khoa có kinh nghiệm. Những chi tiết liên quan đến xử trí trong thai kì và khi sanh sẽ được thảo luận ở phần khác.
HẸP VAN
Hẹp van bẩm sinh hầu hết có liên quan với van ĐMC hai mảnh (BAV). Van ĐMC hai mảnh thường gặp hơn trong tất cả các sang thương bẩm sinh phối hợp. Có thời kỳ, sự phân biệt giữa van ĐMC hai mảnh thật sự và “van hai mảnh chức năng” không chính xác. Do bởi sinh bệnh học và tiên lượng của van ĐMC hai mảnh khác với van ba mảnh, nên sự phân biệt là quan trọng và một chẩn đoán chính xác là cần thiết. Bệnh này thường được nhận biết bằng siêu âm tim và có thể dễ dàng được nhận thấy khi chụp cộng hưởng từ (MRI) ở tim hoặc chụp cắt lớp điện toán (CT) (hình 7.2)
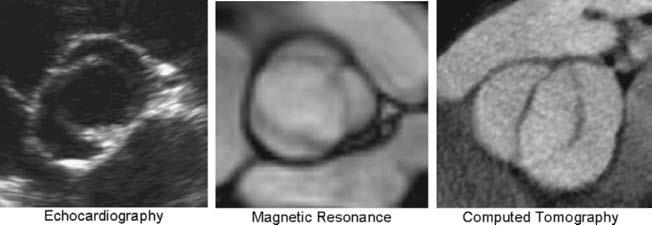
Hình 7.2:Van ĐMC hai mảnh (BAV) sử dụng nhiều dạng chẩn đoán hình ảnh khác nhau, siêu âm tim là chuẩn. MRI và CT chỉ làm khi cần thiết, nếu cửa sổ siêu âm không đủ quan sát. Cũng như siêu âm tim, MRI có thể đo vận tốc và dòng chảy qua van bị hẹp, nhưng CT thì không. CT cũng cần có chất cản âm và phóng xạ. (Echocardiography: siêu âm tim; Magnetic Resonance – MRI: cộng hưởng từ; Computed Tomography – CT: Chụp cắt lớp điện toán)
Những nguyên nhân khác của hẹp van ĐMC bẩm sinh bao gồm van một mảnh và van bốn mảnh. Van một mảnh ít gặp hơn nhưng là nguyên nhân thường gây hẹp van ở tuổi trẻ hơn [5]. Những bệnh nhân này trội hơn ở nam giới [5]. Van bốn mảnh ít gặp hơn và thỉnh thoảng đi kèm với những bất thường bẩm sinh khác như bất thường thân chung, thông liên thất, hoặc những dạng khác của tắc nghẽn đường thoát thất trái. Thường thường hở van hơn là hẹp van [6].
Xử trí van ĐMC hai mảnh (BAV) là một trong những thách thức lâm sàng khó khăn và thường gặp trong bệnh tim bẩm sinh ở người lớn. Thật ra, cũng đã có tuyên bố rằng “Bệnh van ĐMC hai mảnh (BAV) là nguyên nhân tử vong và bệnh tật nhiều hơn tất cả những khiếm khuyết tim bẩm sinh phối hợp khác” [7]. Những khảo sát ủng hộ cho tuyên bố này là tỷ lệ bệnh thường gặp, bệnh có liên quan với hẹp eo ĐMC và bệnh lý của ĐMC ( được thảo luận chi tiết ở chương 8), và khi cần thay van ĐMC có thể có những lựa chọn không hoàn hảo. Do bởi liên quan với những tình trạng khác, van ĐMC hai mảnh có thể được xem như một phần của rối loạn có hệ thống với những bất thường phân tử chuyên biệt / dưới tế bào của thành mạch máu [8,9]. Với điều này trong suy nghĩ, người bác sĩ tiếp xúc với bệnh nhân có van ĐMC hai mảnh sẽ quan tâm về chức năng van nhiều hơn và/ hoặc tham khảo với chuyên gia tim bẩm sinh.
TỶ LỆ
Xấp xỉ 1-2% dân số có van ĐMC hai mảnh, sự đánh giá có thay đổi phụ thuộc vào dân số nghiên cứu. Một nghiên cứu sàng lọc lớn với trên 1000 trẻ sơ sinh đã tìm thấy van ĐMC hai mảnh chiếm 4,5%, một con số tỉ lệ lớn nhất được báo cáo [10]. Một cuộc sàng lọc bắt buộc đối với những quân nhân nam mới tuyển cho lực lượng cảnh sát Ý đã tìm thấy có 0,8% có van ĐMC hai mảnh, phần lớn những người này có vài mức độ của rối loạn chức năng van, thường là hở van [11]. Nhiều nghiên cứu cho thấy con số tỷ lệ ở giữa những thái cực này.
Một nghiên cứu khác cho thấy có 2,5% những người trưởng thành khỏe mạnh có van ĐMC hai mảnh, ở những người này đa số có rối loạn chức năng van. Đây là một phát hiện đáng được quan tâm vì được thực hiện trên những vận động viên được tuyển chọn [12], đã được loại ra những trường hợp nặng. Phần lớn tỉ lệ của tất cả các nghiên cứu cho thấy tính trội ở nam giới.
Chức năng của van ĐMC hai mảnh có khoảng thay đổi rất rộng từ hẹp van nặng tới chức năng van bình thường, tới hở van nặng. Van có thể hẹp nặng từ tuổi ấu thơ, hoặc ở một thái cực khác, chỉ rối loạn chức năng trung bình khi ở tuổi 70. Những nguyên nhân, cơ chế cho khoảng thay đổi rộng này chưa được hiểu biết một cách đầy đủ, mặc dù mức độ biến dạng của lá van khi sinh dường như ảnh hưởng đến chiều hướng lâm sàng trong khoảng thời gian nhất định. Mặc dù hở van mức độ trung bình rất thường gặp trong dân số nghiên cứu được sàng lọc, hẹp van là biến chứng thường gặp hơn và cần phải can thiệp phẫu thuật [2]
SINH BỆNH HỌC
Có thể có nhiều cơ chế về diễn tiến hẹp của van ĐMC hai mảnh. Thử nghiệm van hai mảnh trong một cái bơm tạo sẵn cho thấy sự bất thường dòng xoáy và lực xé tạo bởi lá van, với biến dạng và nếp lằn xếp ở lá van [13]. Có mối liên hệ mật thiết giữa hình dạng và chức năng lá van, sự hợp nhất của lá vành phải và lá không vành bẩm sinh dẫn đến rối loạn chức năng van nhiều hơn là sự hợp nhất giữa lá vành phải và lá vành trái [14]. Phù hợp với điều này, hướng của lá van cũng làm thay đổi kiểu bệnh động mạch chủ, ngay cả khi chức năng của van giống nhau [15]. Những nghiên cứu của sinh bệnh học cho thấy bằng chứng của viêm, vôi hóa và sợi hóa, tương tự như hẹp ở van ba mảnh, và diễn tiến có thể liên quan với tăng lipid máu [16]. Vì thế, những bất thường về dòng chảy đi cặp với khiếm khuyết nền tảng ở mức dưới tế bào, cả hai đóng góp vào sự tiến triển rối loạn chức năng van và bệnh lý ở ĐMC.
CAN THIỆP
Hẹp van ĐMC hai mảnh là bệnh lý nghiêng về xử trí phẫu thuật, và xử trí lâm sàng thường nói về thời điểm của phẫu thuật. Do bởi những triệu chứng cơ năng có thể còn ít hoặc không được bệnh nhân mô tả, trắc nghiệm gắng sức đôi khi cần thiết để phát hiện những triệu chứng khách quan của bệnh nhân [17,18]. Siêu âm tim hàng năm ở những bệnh nhân hẹp không đáng kể thường được khuyến cáo.
Chọn lựa phương cách can thiệp là phẫu thuật hoặc nong van bằng bóng. Ở bệnh nhân trẻ đang thời kỳ phát triển thể chất, nong van bằng bóng thường được ưa chuộng, thường được thực hiện tại những trung tâm nhi khoa. Tuy nhiên, hẹp tái phát là rất có thể. Một khi bệnh nhân tới tuổi trưởng thành, phương pháp nong van bằng bóng không còn chỉ định khi chọn lựa phẫu thuật có thể thực hiện được.
Tuy nhiên các biện pháp ngoại khoa khác nhau đều có nhược điểm. Những chọn lựa thay van là van nhân tạo cơ học, van sinh học, hoặc ghép động mạch phổi tự thân kèm thay van động mạch phổi (phương pháp Ross). Van cơ học cần uống warfarin mỗi ngày. Van sinh học có tuổi thọ nhất định, và ở bệnh nhân trẻ không còn nghi ngờ gì nữa, sẽ cần thêm phẫu thuật về sau. Phương pháp Ross không ngăn ngừa được tình trạng dãn động mạch chủ về sau và đã bị chỉ trích có đúng là một chọn lựa có giá trị cho quần thể bệnh nhân có van ĐMC hai mảnh. Một số phương pháp được sửa đổi để ngăn ngừa điều này nhưng thành công bước đầu còn hạn chế [19]! Dẫu sao phương pháp Ross không đảm bảo một cách chắc chắn là tránh được việc phẫu thuật van ĐMC trong tương lai. Một chọn lựa phẫu thuật khác cho trẻ em và người trẻ là phẫu thuật xẻ van, tuy nhiên khoảng 40% sẽ phải phẫu thuật lại lúc 25 tuổi [20]. Sửa van có thể thực hiện ở hở van ĐMC, mặc dù khả năng cao cần được phẫu thuật lần nữa [21].
Những bệnh nhân có van ĐMC hai mảnh trẻ hơn có thể có dãn ĐMC kèm theo nhiều hơn, quan tâm đến thai kỳ về sau nhiều hơn, và hơn thế nữa họ cần có một cuộc phẫu thuật thành công cho giai đoạn sau của đời sống so với những bệnh nhân hẹp van ĐMC với van ba mảnh. Bởi vì điều này, không có khuyến cáo nào trên thế giới có liên quan tới phân loại của phẫu thuật van. Đường kính đoạn ĐMC lên phải được xem xét, và một sự kết hợp của thay van ĐMC tạm thời tại gốc hoặc tạo đường dẫn từ van đến động mạch chủ lên (phương pháp Bentall) [22] thường được kỳ vọng. Kinh nghiệm của nơi phẫu thuật, bệnh tật phối hợp với lối sống của bệnh nhân, sở thích, tất cả sẽ được xem xét quyết định trong việc tiến hành thực hiện. Phẫu thuật viên, bác sĩ tim mạch và bệnh nhân cần thỏa thuận về cách tiếp cận tốt nhất.
THEO DÕI LÂU DÀI
Do những phức tạp đã đề cập như trên, không bệnh nhân nào có phẫu thuật hẹp van động mạch chủ hai mảnh trước đó được xem là đã “chữa lành”, và tất cả sẽ được xem xét định kỳ. Hở van ĐMC sau thay gốc ĐMC có giữ lại van thường gặp [21]. Van nhân tạo sinh học hoặc van ghép tự thân cũng có tỷ lệ thất bại nhất định. Bệnh nhân sẽ được hướng dẫn những vấn đề liên quan như bệnh lý ĐMC (xem chương 8), hoặc viêm nội tâm mạc nhiễm trùng, và là phụ nữ sẽ thảo luận về vấn đề mang thai trong tương lai.
Vì những lý do này, việc theo dõi hàng năm bao gồm cả siêu âm tim thường qui được đảm bảo cho tất cả bệnh nhân có hẹp ĐM chủ bẩm sinh trước đó.
VIÊM NỘI TÂM MẠC
Van ĐMC hai mảnh tăng nguy cơ viêm nội tâm mạc nhiễm trùng. Trong một khảo sát lớn ở bệnh nhân viêm nội tâm mạc nhiễm trùng, 13% có van ĐMC hai mảnh [23], một tỉ lệ cao hơn nhiều so với dự đoán ở dân số bình thường. Viêm nội tâm mạc nhiễm trùng ảnh hưởng từ 10-30% bệnh nhân có van ĐMC hai mảnh trong đời sống của họ [24], với tỉ lệ nguy cơ được báo cáo là 27/10.000 người mỗi năm [20]. Vi khuẩn thường gặp là nhóm Streptococcus biến thể.
Những ấn phẩm trước đó khuyến cáo trên toàn cầu dùng kháng sinh dự phòng trước những thủ thuật về nha khoa, hoặc những phương pháp xâm nhập khác khi tiếp xúc với môi trường không vô trùng [24]. Tuy nhiên, những khuyến cáo của hiệp hội tim mạch Hoa Kỳ/ trường môn tim mạch Hoa Kỳ (AHA/ACC) năm 2007 gần đây ngược lại với khuyến cáo này [25]. Những hướng dẫn mới này, được biên soạn bởi một lực lượng đặc biệt đa chuyên khoa lớn, sau khi xem xét tất cả các dữ liệu có sẵn, bao gồm bằng chứng hiện tại không biện minh được cho việc dùng kháng sinh trước trị liệu cho đa số bệnh nhân. Riêng trong lĩnh vực nha khoa, du khuẩn huyết thường gặp ngay cả với việc chải răng và dùng chỉ nha khoa mỗi ngày, và không phải chỉ đơn độc trong khi can thiệp nha khoa. Vì vậy những hướng dẫn nhấn mạnh đến sự cần thiết của thói quen giữ vệ sinh răng miệng tốt và khuyến cáo kháng sinh chỉ dùng ở những bệnh nhân mới đặt vật liệu nhân tạo hoặc ở những người mà viêm nội tâm mạc nhiễm trùng đã gây biến chứng đặc biệt, như ở bệnh nhân với bệnh tim bẩm sinh tím. Vì thế, phần lớn bệnh nhân có hẹp van ĐMC không rơi vào nhóm này và không dùng kháng sinh dự phòng theo khuyến cáo mới. Sự thay đổi đáng kể này và những liên quan sẽ được suy nghĩ, xem xét bởi mỗi thầy thuốc. Để xem xét các hướng dẫn và suy luận một cách đầy đủ, người đọc được khuyến khích nghiên cứu tài liệu ở mức chi tiết [25] và tư vấn với bệnh nhân về từng vấn đề cơ bản của bản thân họ.
HẸP DƯỚI VAN ĐMC
Gần như 1/3 các trường hợp hẹp đường thoát thất trái có thể được xếp vào nhóm hẹp dưới ĐMC (SAS: Subaotic Stenosis). Nổi trội của việc này là sự phát triển quá mức của mô sợi đàn hồi bắt ngang một số phần của đường thoát thất trái. Hẹp dưới van ĐMC có thể là phần mô nhô ra bị gián đoạn – giống như cái gờ, hoặc ít gặp hơn là hẹp theo chu vi dạng đường hầm (hình 7.3).
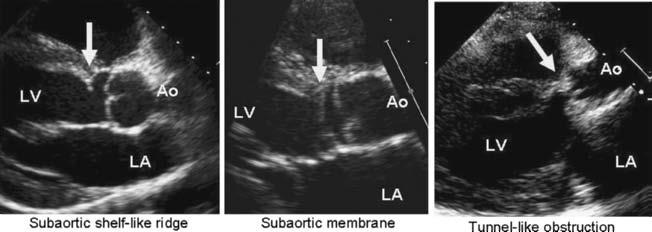
Hình 7.3: Những ví dụ về các dạng của hẹp dưới ĐMC khi xem ở mặt cắt cạnh ức trục dọc ở siêu âm tim qua thành ngực. LV: thất trái ; LA: nhĩ trái ; Ao: động mạch chủ
Mức độ và phân loại của những khiếm khuyết dao động trong một khoảng rộng, bởi vì những sang thương có thể mỏng và tinh tế, hình ảnh có thể không biểu lộ đầy đủ để đánh giá hết bất thường so với khi kiểm tra trong lúc phẫu thuật [26].
Hẹp dưới ĐMC thường liên quan với những bất thường bẩm sinh khác. Thường nhất là thông liên thất có thể gặp tới 1/3 số bệnh nhân [27]. Sự sai lệch giữa vách liên thất và vòng van hoặc khoảng cách giữa ĐMC và vòng van 2 lá có thể tạo nên sự tắc nghẽn [28]. Van ĐMC hai mảnh chiếm gần ¼ số bệnh nhân có hẹp dưới ĐMC [29], mặc dù nó không gây rối loạn chức năng nhiều hơn van ba mảnh trong cùng cách sắp đặt [2]. Những khiếm khuyết khác đi kèm với hẹp dưới ĐMC gồm hẹp eo ĐMC, tồn tại ống động mạch, tồn tại tĩnh mạch chủ trên trái, thiểu sản tại gốc ĐMC hoặc bất thường van 2 lá. Hệ thống nâng đỡ van 2 lá có thể góp phần gây tắc nghẽn do gắn bất thường vào vách liên thất gần đường thoát thất trái [30]. Hội chứng Shone [31] là một tập hợp những bệnh hẹp hàng loạt, cụ thể là hẹp eo ĐMC, hẹp dưới ĐMC, van hai lá hình dù hoặc có vòng trên van hai lá. Đa tổn thương hẹp, bằng chứng như trường hợp trên, thêm sự phức tạp và tiên lượng xấu hơn [32]. Một dạng của hẹp dưới ĐMC mắc phải có thể tiến triển sau khi sửa chữa những dạng khác của các khiếm khuyết bẩm sinh, bao gồm kênh nhĩ thất (nơi ĐMC không còn vị trí hình chêm và đường thoát bị kéo dài ra) và phẫu thuật kiểu Rastelli của thất phải hai đường ra [33]. Giống như bất kì dạng nào của tăng hậu tải, phì đại buồng tim dưới van gây ra tắc nghẽn dòng chảy về mặt động học, và bản thân điều này tạo ra một vòng lẩn quẩn làm sự tắc nghẽn tệ hơn và vì vậy gây phì đại nặng hơn.
CAN THIỆP
Giống như hẹp van, hẹp dưới ĐMC là một bệnh nghiêng về ngoại khoa và thường cần can thiệp. 60% bệnh nhân được chẩn đoán hẹp dưới ĐMC từ tuổi thơ sẽ phải chịu cuộc phẫu thuật lúc 17 tuổi [34]. Sang thương phải không được xem nhẹ cũng như những nguy cơ của phẫu thuật, vì đã có báo cáo về những trường hợp tử vong sớm, thường trong thời kỳ chu phẫu [35]. Vì vậy, can thiệp được thực hiện tốt nhất bởi phẫu thuật viên thạo việc với cái nhìn tổng quát về hẹp dưới ĐMC và những biến chứng lâu dài của nó.
Một câu hỏi khó về mặt lâm sàng là khi nào phẫu thuật. Triệu chứng là một chỉ điểm không chắc chắn về độ nặng của tắc nghẽn [29]. Một chênh áp >50mmHg có tiên lượng xấu khi không can thiệp [36], và vì vậy, ngay cả khi không có triệu chứng, cuộc giải phẫu được đề nghị khi chênh áp đỉnh hiện tại tăng đáng kể. Tuy nhiên, dưới mức này, thật khó để nói chắc chắn rằng khi nào can thiệp đáng được thực hiện, và phần lớn bệnh nhân cần gặp bác sĩ tim mạch có kiến thức trong lĩnh vực này để giúp đưa ra những quyết định.
Không có những thử nghiệm tiền cứu ngẫu nhiên về chiến lược xử trí tốt nhất và thời gian can thiệp, nhưng đồng thuận chung từ nhiều báo cáo phẫu thuật cho thấy khuynh hướng thích can thiệp sớm hơn là can thiệp muộn (Vd chênh áp trung bình >30mmHg), đặc biệt ở trẻ em [34], bệnh nhân nữ có quan tâm đến việc mang thai sau này hoặc những vận động viên [2]. Tuy nhiên, ở khía cạnh người trưởng thành không triệu chứng, dường như có ít bằng chứng cho việc can thiệp sớm là tốt. Những tóm tắt mới xuất bản gần đây gợi ý ở những người trưởng thành có chênh áp <50mmHg qua siêu âm tim và không có phì đại thất trái hoặc không triệu chứng sẽ được theo dõi, và phẫu thuật sớm hơn như là cách để duy trì sự toàn vẹn của van ĐMC (xem bên dưới) không là lý do để có chỉ định phẫu thuật [36]. Theo dõi lâu hơn sẽ quyết định giá trị của những khuyến cáo dành cho người trưởng thành.
Phần lớn các phẫu thuật thành công trong khoảng thời gian ngắn, lý tưởng là không có tắc nghẽn tồn lưu (hình 7.4).
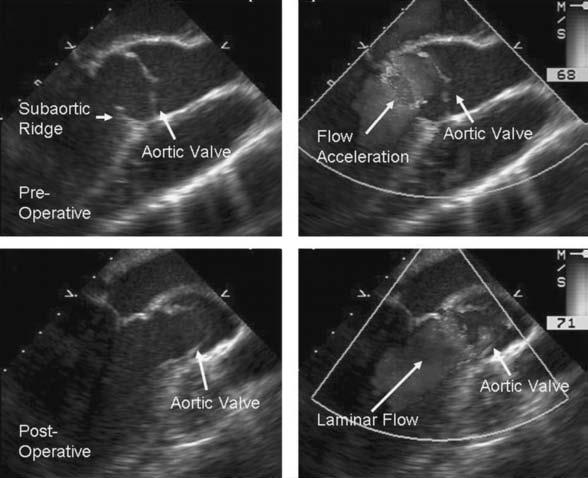
Hình 7.4:Siêu âm tim qua thực quản (xoay 110 độ). Hai hình trước (a, b) và sau (c, d) phẫu thuật cắt gờ dưới ĐMC, cho thấy không có (a, c) và có (b, d) trên Doppler màu. Trước phẫu thuật có một cái gờ nhỏ (a), và sự tăng tốc dòng chảy dưới van dễ dàng tăng lên trong giai đoạn đầu thì tâm thu (b), lưu ý lá van bắt đầu mở. Sau phẫu thuật, màng đã được loại bỏ (c), dòng chảy lớp qua đường thoát thất trái đã được phục hồi (hình ảnh giữa thì tâm thu, d)
Kết quả phụ thuộc vào sang thương của mỗi cá thể và phẫu thuật viên cắt bỏ mô nhiều hay ít. Cắt nhiều làm tăng nguy cơ của tắc nghẽn dẫn truyền nhĩ thất, tổn thương lá van hai lá hoặc bộ phận nâng đỡ, hoặc tạo ra thông liên thất. Phẫu thuật viên có thể chỉ loại bỏ màng gây tắc nghẽn, hoặc thường gặp là cắt bỏ cơ rộng hơn. Trường hợp hẹp dạng đường hầm, cần mở rộng đường thoát thất trái bằng cách đặt một miếng vá hình thoi là điển hình, đây là phương pháp Konno [37], hoặc phương pháp có sửa đổi là để lại van ĐMC.
NHỮNG BIẾN CHỨNG LÂU DÀI
Tắc nghẽn tái phát thường gặp, một lần nữa chứng minh sự theo dõi cẩn thận trong thời gian dài là đúng. Một vài mức độ hẹp thường hiện diện ở ngay thất phải sau phẫu thuật [38], và 20-30% sẽ có tái hẹp đáng kể trong vòng 10 năm [29]. Những yếu tố tiên đoán cho phẫu thuật lại bao gồm mức độ hẹp trước phẫu thuật [34, 39], hẹp dạng đường hầm [29, 40], và mức độ tắc nghẽn đường thoát thất trái ngay sau phẫu thuật [29, 41]. Những dấu hiệu này củng cố thêm lý lẽ cho sự can thiệp sớm hơn trước khi độ chênh áp chuyển nặng ở trẻ con [29], mặc dù sự tái hẹp ít gặp hơn khi bệnh nhân được phẫu thuật ở tuổi trưởng thành [36].
Những nguyên nhân có thể gây tái phát được nghiên cứu sâu trong các ấn bản từ một thập niên trước [26], và cho đến nay ít có thay đổi về đồng ý hay bác bỏ. Nguy cơ cao hơn ở bệnh nhân có đường thoát thất trái (LVOT) dài hơn hoặc hẹp hơn, có sự sai lệch của vách liên thất tạo ra độ dốc hợp thành góc “động mạch chủ-vách liên thất” (“aorto-septal”), và nơi có đáp ứng tế bào nội mạch do biến đổi cơ học dòng chảy và/ hoặc lực xé dẫn đến tăng trưởng mô sợi hoặc phì đại lớp cơ [26].
Hẹp dưới ĐMC có liên quan đến tiến triển của hở van ĐMC, đặc biệt chiếm ¼ các trường hợp theo dõi trên 10 năm [40]. Hở van có khuynh hướng ở mức độ nhẹ [42], mặc dù phẫu thuật van ĐMC muộn cần có sau khi cắt đoạn dưới ĐMC xảy ra gần một nửa số bệnh nhân có chênh áp cao trước mổ [29]. Cơ chế bệnh van ĐMC gặp trong hẹp dưới ĐMC có thể là tổn thương lá van ĐMC do dòng máu xoáy đập vào dẫn đến biến dạng, tổn thương nội mô, dư lá van, sa van và rối loạn chức năng [2]. Can thiệp sớm hơn có thể ít hư tổn van hơn và vì thế bảo tồn được chức năng [43] mặc dù không phải tất cả các nghiên cứu đều có kết luận tương tự [44].
VIÊM NỘI TÂM MẠC
Cũng như hẹp van ĐMC hai mảnh, hẹp dưới ĐMC có nguy cơ viêm nội tâm mạc nhiễm trùng [2]. Ngược với những khuyến cáo trước đây [2,24], những hướng dẫn hiện tại không khuyến cáo dùng kháng sinh dự phòng một cách thường qui trong hẹp dưới ĐMC [25]. Tuy nhiên dự phòng vẫn được khuyến cáo ở những bệnh nhân có “sự sửa chữa bệnh tim bẩm sinh với khiếm khuyết còn tồn lưu ở tại vị trí hoặc gần với vị trí của miếng vá nhân tạo hoặc dụng cụ nhân tạo” [25]. Một số bệnh nhân hẹp dưới ĐMC có sửa chữa bằng miếng vá trước đó có khả năng rơi vào nhóm này. Vì vậy không nên hiểu các khuyến cáo mới là tuyệt đối để thay thế hoàn toàn thực hành lâm sàng hiện nay. Hơn nữa, tất cả bệnh nhân được khuyến khích thực hành giữ vệ sinh răng miệng tốt, và bác sĩ sẽ hướng dẫn cho bệnh nhân về những lý luận trong hướng dẫn mới.
HẸP TRÊN VAN
Hẹp trên van là dạng ít gặp nhất của tắc nghẽn đường thoát thất trái. Điển hình là xảy ra tại chỗ hoặc gần với điểm nối xoang ống. Giống như hẹp tại van và dưới van ĐMC, hẹp trên van ĐMC ở nam giới chiếm ưu thế hơn và đã được báo cáo trong y văn [45].
Phần lớn hẹp trên van gặp ở những bệnh nhân có hội chứng Williams – Beuren, chiếm xấp xỉ 60% các trường hợp. Hội chứng hiếm này được định nghĩa lần đầu tiên vào năm 1961, là một khiếm khuyết gen trội trên nhiễm sắc thể thường, đặc trưng bởi nhiều chổ hẹp trên mạch máu (ĐM chủ, ĐM phổi, hẹp eo ĐMC, và/ hoặc hẹp ĐM thận), đi kèm với hình dạng khuôn mặt –mắt điển hình; những đặc trưng về mặt tâm thần –xã hội, nhận thức, được mô tả chi tiết ở phần khác [46,47] . Hẹp trên van ĐMC, đi kèm với những biến dạng nội mạch khác phản ánh tình trạng bệnh lý của động mạch. Trong cả hội chứng Williams và những trường hợp tắc nghẽn trên van riêng lẻ, bằng chứng về sự biến đổi gen liên quan elastin đã được mô tả [48]. Cùng tồn tại với những sang thương bẩm sinh là qui luật hơn là ngoại lệ [49]. Bổ sung cho điều này, thường gặp van ĐMC hai mảnh cũng như bất thường cả vị trí xuất phát và hình dạng của ĐM vành. Vì vậy, mỗi khi hẹp trên van ĐMC được xác định, bác sĩ lâm sàng sẽ phải xem xét cả hệ mạch máu phổi và mạch máu hệ thống xa hơn nhằm tìm những bất thường khác phối hợp, bao gồm cả động mạch vành [50], hơn là phỏng đoán khiếm khuyết chỉ tồn tại biệt lập. Thật ra, tăng huyết áp tương đối trong động mạch vành, do nằm ở phần trước chổ hẹp bệnh nhân cần được khảo sát bệnh động mạch vành và được chú ý kỹ điều trị các yếu tố nguy cơ của xơ vữa động mạch.
Hẹp trên van dường như là tiến triển theo thời gian [51]. Phẫu thuật cắt đoạn điển hình được chỉ định khi có hẹp đáng kể, cũng như được quyết định bởi những triệu chứng cơ năng, phì đại thất trái đáng kể, hoặc chênh áp nặng hơn theo thời gian. Không giống như hẹp dưới van, hẹp trên van một khi đã phẫu thuật có tỉ lệ tái hẹp muộn thấp hơn [52]. Theo dõi lâu dài cần được thực hiện để kiểm soát tình trạng tăng huyết áp và phát hiện hẹp ở những mạch máu khác mà nó dần trở nên rõ ràng hơn theo thời gian.
KẾT LUẬN VỀ TRƯỜNG HỢP LÂM SÀNG
Xem xét độ nặng những triệu chứng của bệnh nhân, chênh áp qua buồng tống thất trái, van St. Jude tương đối nhỏ, và tăng áp lực cuối tâm trương ở thất trái, và sau nhiều lần thảo luận với bệnh nhân, gia đình và nhóm chăm sóc mở rộng ở tại trung tâm bệnh tim bẩm sinh, một quyết định được đưa ra là tiến hành lại thay van ĐMC kèm với cắt đoạn dưới ĐMC. Cuộc phẫu thuật được lên kế hoạch vào mùa hè trước khi bệnh nhân bắt đầu vào học nội trú về chuyên ngành cô ta đã chọn.
Cuộc phẫu thuật diễn ra phức tạp do sẹo cũ đáng kể. Khi rạch vào van St. Jude trước đó, phẫu thuật viên đã qua sát thấy vết rách ở lá trước van hai lá do miếng vá khi cắt cơ trước đó gây ra, với miếng Dacron vươn dài đến lá trước van hai lá. Vòng van không còn nguyên vẹn. Vì thế, phẫu thuật viên tái tạo lại chổ nối ở vòng van và sửa chữa van hai lá. Ở vị trí van ĐMC, ngay cả sau khi mở rộng ra làm sạch mô sẹo, vòng van chỉ giữ được van St. Jude 19mm nên sẽ không cải thiện hơn tình trạng trước đó của bệnh nhân. Vì lý do này, phẫu thuật viên chọn cách thay van St. Jude bằng van ĐM phổi ghép tự thân (phương pháp Ross). Cuộc phẫu thuật căng thẳng và kéo dài, nhưng bệnh nhân được đưa về khoa chăm sóc tích cực trong tình trạng ổn định.
Quá trình hồi phục của bệnh nhân cực kỳ khó khăn. Bệnh nhân có rối loạn chức năng thất trái đáng kể đòi hỏi phải dùng nhiều thuốc tăng co bóp và thuốc vận mạch. Quá trình chăm sóc cô ta có biến chứng phù phổi bắt buộc phải đặt nội khí quan lâu dài, suy thận cấp điều trị bằng chạy thận nhân tạo, cuồng nhĩ và blốc nhĩ thất hoàn toàn cần đặt máy tạo nhịp vĩnh viễn. Sau ba tuần, tình trạng bệnh nhân ổn định và cô ấy được cho xuất viện về nhà với sự hỗ trợ của gia đình. Siêu âm tim của bệnh nhân lúc xuất viện cho thấy có giảm chức năng tâm thu thất trái trung bình, nhưng độ chênh áp qua buồng tống không đáng kể.
Nhiều tuần kế tiếp, bệnh nhân tiến triển chậm và vài lần phải nhập viện. Vấn đề ghép tim được xem xét nhưng không thể có ngay. Mười tuần sau phẫu thuật, bệnh nhân vẫn không nhận biết được tốt hơn và người nhà đã đưa cô ấy trở lại bệnh viện. Bệnh nhân ngất trên xe hơi. Buổi tối sau khi nhập viện, cô ấy có ngừng tim. Bệnh nhân được giữ ổn định lúc ban đầu, nhưng những ngày sau đó, tình trạng của bệnh nhân ngày càng xấu hơn mặc dù thuốc tăng co bóp và thuốc vận mạch dùng ở liều tấn công. Huyết áp tụt và hồi sức không thành công. Mổ tử thi cho thấy chỗ mổ còn nguyên vẹn nhưng phì đại thất trái nặng với hoại tử cơ tim bán cấp lan tỏa, có khả năng xảy ra do chạy tim phổi nhân tạo lần gần đây nhất.
Cái chết của bệnh nhân cuối cùng cũng phản ánh một sự phối hợp của những phẫu thuật phức tạp trước đó, phì đại thất trái với chức năng thất trái trước mổ mong manh; sự khó khăn trong lúc phẫu thuật liên quan đến kích thước vòng van ĐMC, và thời gian dùng tim phổi nhân tạo kéo dài, đỉnh điểm là rối loạn chức năng thất trái nặng mà không thể giữ ổn định được. Qua bi kịch này, trường hợp của bệnh nhân không ngoại lệ và nhắc nhở chúng ta sự phức tạp của bệnh này và nhiều dạng bệnh tim bẩm sinh khác.
TÀI LIỆU THAM KHẢO
- Yacoub MH, Kilner PJ, Birks EJ, Misfeld M. The aortic outflow and root: a tale of dynamism and crosstalk. Ann Thorac Surg 1999;68:S37–43.
- Aboulhosn J, Child JS. Left ventricular outflow obstruction: subaortic stenosis, bicuspid aortic valve, supravalvar aortic stenosis, and coarctation of the aorta. Circulation2006;114:2412–22.
- Spataro A, Pelliccia A, Rizzo M, et al. The natural course of bicuspid aortic valve in athletes. Int J Sports Med 2008;29:81–5.
- Siu SC, Sermer M, Colman JM, et al. Prospective multicenter study of pregnancy outcomes in women with heart disease. Circulation 2001;104:515–21.
- Collins MJ, Butany J, Borger MA, et al. Implications of a congenitally abnormal valve: a study of 1025 consecutively excised aortic valves. J Clin Pathol 2008;61:530–6.
- Tutarel O. The quadricuspid aortic valve: a comprehensive review. J Heart Valve Dis 2004;13:534–7.
- Verma S, Szmitko PE, Fedak PW, et al. Can statin therapy alter the natural history of bicuspid aortic valves? Am J Physiol Heart Circ Physiol 2005;288:H2547–9.
- FedakPW, de SaMP,Verma S, et al.Vascular matrix remodeling in patients with bicuspid aortic valve malformations: implications for aortic dilatation. J Thorac CardiovascSurg 2003;126:797–806.
- Warnes CA. Bicuspid aortic valve and coarctation: two villains part of a diffuse problem. Heart 2003;89:965–6.
- Tutar E, Ekici F, Atalay S, Nacar N. The prevalence of bicuspid aortic valve in newborns by echocardiographic screening. Am Heart J 2005;150:513–15.
- Nistri S, Basso C, Marzari C, et al. Frequency of bicuspid aortic valve in young male conscripts by echocardiogram. Am J Cardiol 2005;96:718–21.
- Stefani L, Galanti G, Toncelli L, et al. Bicuspid aortic valve in competitive athletes. BrJ Sports Med 2008;42:31–5.
- Robicsek F, Thubrikar MJ, Cook JW, Fowler B. The congenitally bicuspid aortic valve: how does it function? Why does it fail? Ann Thorac Surg 2004;77:177–85.
- Fernandes SM, Khairy P, Sanders SP, Colan SD. Bicuspid aortic valve morphology and interventions in the young. J Am Coll Cardiol 2007;49:2211–14.
- Schaefer BM, Lewin MB, Stout KK, et al. Usefulness of bicuspid aortic valve phenotype to predict elastic properties of the ascending aorta. Am J Cardiol 2007;99: 686–90.
- Chan KL, Ghani M, Woodend K, Burwash IG. Case-controlled study to assess risk factors for aortic stenosis in congenitally bicuspid aortic valve. Am J Cardiol 2001;88: 690–3.
- Chambers J. Exercise testing to guide surgery in aortic stenosis. Heart 1999;82:7–8.
- Das P, Rimington H, Chambers J. Exercise testing to stratify risk in aortic stenosis. EurHeart J 2005;26:1309–13.
- Slater M, Shen I,Welke K, et al. Modification to the Ross procedure to prevent autograft dilatation. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2005:181–4.
- Keane JF, Driscoll DJ, Gersony WM, et al. Second natural history study of congenital heart defects. Results of treatment of patients with aortic valvar stenosis. Circulation 1993;87:I16–27.
- Alsoufi B, Borger MA, Armstrong S, et al. Results of valve preservation and repair for bicuspid aortic valve insufficiency. J Heart Valve Dis 2005;14:752–8,discussion 758–9.
- Bentall H, De Bono A. A technique for complete replacement of the ascending aorta. Thorax 1968;23:338–9.
- Choudhury R, Grover A, Varma J, et al. Active infective endocarditis observed in an Indian hospital 1981–1991. Am J Cardiol 1992;70:1453–8.
- Brickner ME. Valvar aortic stenosis. In: Gatzoulis MA, Webb GD, Daubeney PE, eds. Diagnosis and Management of Adult Congenital Heart Disease (1st edition). London:Churchill Livingstone, 2003:213–21.
- WilsonW,Taubert KA, Gewitz M, et al. Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on CardiovascularDisease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007;116:1736–54.
- Freedom RM. The long and the short of it: some thoughts about the fixed forms of left ventricular outflow tract obstruction. J Am Coll Cardiol 1997;30:1843–6.
- Kitchiner D, Jackson M, Malaiya N, et al. Morphology of left ventricular outflow tract structures in patients with subaortic stenosis and a ventricular septal defect. Br HeartJ 1994;72:251–60.
- Rosenquist GC, Clark EB, McAllister HA, et al. Increased mitral-aortic separation in discrete subaortic stenosis. Circulation 1979;60:70–4.
- Brauner R, Laks H, Drinkwater DC Jr, et al. Benefits of early surgical repair in fixed subaortic stenosis. J Am Coll Cardiol 1997;30:1835–42.
- Marasini M, Zannini L, Ussia GP, et al. Discrete subaortic stenosis: incidence, morphology and surgical impact of associated subaortic anomalies. Ann Thorac Surg 2003;75:1763–8.
- Shone JD, Sellers RD, Anderson RC, et al. The developmental complex of “parachute mitral valve,” supravalvular ring of left atrium, subaortic stenosis, and coarctation of aorta. Am J Cardiol 1963;11:714–25.
- Bolling SF, Iannettoni MD, Dick M 2nd, et al. Shone’s anomaly: operative results and late outcome. Ann Thorac Surg 1990;49:887–93.
- KalfaD, Ghez O, Kreitmann B, Metras D. Secondary subaortic stenosis in heart defects without any initial subaortic obstruction: a multifactorial postoperative event. Eur JCardiothorac Surg 2007;32:582–7.
- Karamlou T, Gurofsky R, Bojcevski A, et al . Prevalence and associated risk factors for intervention in 313 children with subaortic stenosis. Ann Thorac Surg 2007;84:900–6, discussion 906.
- Erentug V, Bozbuga N, Kirali K, et al. Surgical treatment of subaortic obstruction in adolescent and adults: long-term follow-up. J Card Surg 2005;20:16–21.
- Gersony WM. Natural history of discrete subvalvar aortic stenosis: management implications. J Am Coll Cardiol 2001;38:843–5.
- Konno S, Imai Y, Iida Y, et al. A new method for prosthetic valve replacement in congenital aortic stenosis associated with hypoplasia of the aortic valve ring. J Thorac Cardiovasc Surg 1975;70:909–17.
- Jones M, Barnhart GR, Morrow AG. Late results after operations for left ventricular outflow tract obstruction. Am J Cardiol 1982;50:569–79.
- Parry AJ, Kovalchin JP, Suda K, et al. Resection of subaortic stenosis; can a more aggressive approach be justified? Eur J Cardiothorac Surg 1999;15:631–8.
- van Son JA, Schaff HV, Danielson GK, et al. Surgical treatment of discrete and tunnel subaortic stenosis. Late survival and risk of reoperation. Circulation 1993;88:II159–69.
- Serraf A, Zoghby J, Lacour-Gayet F, et al. Surgical treatment of subaortic stenosis: a seventeen-year experience. J Thorac Cardiovasc Surg 1999;117:669–78.
- Oliver JM, Gonzalez A, Gallego P, et al.Discrete subaortic stenosis in adults: increased prevalence and slow rate of progression of the obstruction and aortic regurgitation. J Am Coll Cardiol 2001;38:835–42.
- Coleman DM, Smallhorn JF, McCrindle BW, et al. Postoperative follow-up of fibromuscular subaortic stenosis. J Am Coll Cardiol 1994;24:1558–64.
- de Vries AG, Hess J, Witsenburg M, et al. Management of fixed subaortic stenosis: a retrospective study of 57 cases. J Am Coll Cardiol 1992;19:1013–17.
- Harikrishnan S, Manohar SR, Nair KK, et al. Supravalvar aortic stenosis: clinical and hemodynamic profile, and surgical outcome. Indian Heart J 2003;55:49–54.
- Morris CA, Leonard CO, Dilts C, Demsey SA. Adults with Williams syndrome. AmJMed Genet Suppl 1990;6:102–7.
- Morris CA, Demsey SA, Leonard CO, et al. Natural history of Williams syndrome: physical characteristics. J Pediatr 1988;113:318–26.
- Ewart AK, Jin W, Atkinson D, et al. Supravalvular aortic stenosis associated with a deletion disrupting the elastin gene. J Clin Invest 1994;93:1071–7.
- Wang CC, Hwu WL, Wu ET, et al. Outcome of pulmonary and aortic stenosis in Williams-Beuren syndrome in an Asian cohort. Acta Paediatr 2007;96: 906–9.
- van Pelt NC, Wilson NJ, Lear G. Severe coronary artery disease in the absence of supravalvular stenosis in a patient with Williams syndrome. Pediatr Cardiol 2005;26: 665–7.
- Wren C, Oslizlok P, Bull C. Natural history of supravalvular aortic stenosis and pulmonary artery stenosis. J Am Coll Cardiol 1990;15:1625–30.
- Flaker G, Teske D, Kilman J, et al. Supravalvular aortic stenosis. A 20-year clinical perspective and experience with patch aortoplasty. Am J Cardiol 1983;51: 256–60.

Để lại bình luận
Bạn cần phải đăng nhập để đăng bình luận.