( BẤT TƯƠNG HỢP ĐÔI – cTGA )
Sara A.Thorne
Người dịch: BS Lê Kim Tuyến
Một nữ doanh nhân 30 tuổi nhập viện vì cơn rung nhĩ . Chẩn đoán ban đầu là bất tương hợp đôi kèm thông liên thất và hẹp dưới van ĐMP. Bệnh nhân đã được phẫu thuật đóng thông liên thất và cắt lọc dưới van ĐMP cách đây 20 năm. Bệnh nhân có NYHA I, có hở van 3 lá “ hệ thống” mức độ trung bình .
Khám thực thể ghi nhận thất phải tăng động , tiếng T2 đơn độc và âm thổi toàn tâm thu cạnh bờ trái xương ức. Điện tim được ghi nhận lại (hình 6.1). Xquang ngực có bóng tim và định vị phủ tạng bình thường, gù vẹo cột sống ,bờ trái bóng tim thẳng. Siêu âm tim khẳng định chẩn đoán có hở van 3 lá nặng dòng trung tâm, thất phải phì đại nhưng không giãn và chức năng thất bảo tồn. Bệnh nhân chạy gắng sức được 8 phút của qui trình Bruce (Bruce protocol).
Định nghĩa :
Bất tương hợp đôi bao gồm bất tương hợp nhĩ thất và bất tương hợp thất đại động mạch. Do đó, máu tĩnh mạch hệ thống vào nhĩ phải qua van hai lá vào thất có dạng thất trái, lên ĐMP. Máu TMP từ nhĩ trái qua van 3 lá vào thất có dạng thất phải lên ĐMC (hình 6.2).
Như vậy, máu “đen”được bơm lên tuần hoàn phổi, và máu “đỏ” được bơm vào tuần hoàn hệ thống, có nghĩa hệ tuần hoàn về sinh lý “được sửa chữa”. Tuy nhiên, không đúng về vị trí giải phẫu,vì thất phải và van 3 lá bơm máu cho tuần hoàn hệ thống.

Hình 6.1 : ECG nhịp xoang với trục lệch phải, phì đại thất phải và sóng T đảo ngược
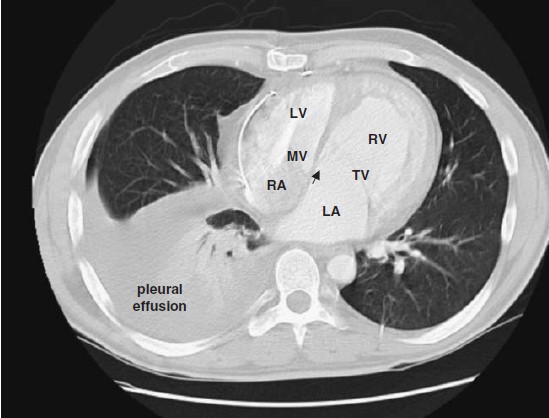
Hình 6.2 : CT của bệnh nhân nam 28 tuổi bị bất tương hợp đôi. Thất phải hệ thống dãn và phì đại, vách liên thất phồng về phía trái. Dịch chuyển van 3 lá về phía mỏm ( mũi tên). Bị nhiễu ở van 2 lá do dây điện cực trong thất trái ở dưới ĐMP. Bệnh nhân bị tràn dịch màng phổi phải lượng nhiều. LA, nhĩ trái; LV,thất trái ; MV,van 2 lá ; RA,nhĩ phải ; RV, thất phải; TV, van 3 lá.
Thuật ngữ :
- Bất tương hợp nhĩ thất : tâm nhĩ kết nối sai với tâm thất ; nhĩ phải kết nối với thất trái qua van 2 lá, và nhĩ trái kết nối với thất phải qua van 3 lá.
- Bất tương hợp thất đại động mạch : đại động mạch kết nối sai với tâm thất( nghĩa là chúng bị chuyển vị) ĐMC xuất phát từ thất phải và ĐMP từ thất trái.
- Bất tương hợp đôi còn gọi là chuyển vị đại động mạch dạng L, do bất thường xoay trái của ống tim ở thời kỳ phôi thai gây ra bệnh lý này. Do đó ĐMC nằm phía trước bên trái thân ĐMP. So sánh với chuyển vị đại động mạch đơn thuần ( d- TGA), có xoay phải của ống tim ở thời kỳ phôi thai thường dẫn đến ĐMC nằm phía trước và bên phải của thân ĐMP.
Tỷ lệ bệnh :
Bệnh bất tương hợp đôi hiếm gặp, chiếm <1% bệnh TBS. 95% có liên quan đến bất thường tim. Sự đa dạng của những bất thường kết hợp làm bệnh cảnh lâm sàng phong phú và thời điểm khởi bệnh bất kỳ từ giai đoạn sơ sinh đến lứa tuổi 70 .
Các bệnh kèm bao gồm:
- Thông liên thất
- Hẹp van ĐMP & không lỗ van ĐMP
- Bất thường van 3 lá dạng Ebstein.
- Kênh nhĩ thất
- Hẹp eo ĐMC
- Bất thường định vị phủ tạng, mỏm tim bên phải, chính giữa
- Block nhĩ thất bẩm sinh.
Thông liên thất chiếm 70% trường hợp và thường là phần màng. Nếu TLT lỗ lớn và không có bảo vệ phổi thì triệu chứng xảy ra sớm kèm với suy tim.
Hẹp phổi chiếm 40% trường hợp. Có thể hẹp tại van hoặc dưới van, do vòng xơ hoặc phình của vách liên thất.
Sự kết hợp của TLT và hẹp phổi trong bất tương hợp đôi là thường gặp, và nếu “cân bằng tốt”, bệnh nhân có thể sống khỏe đến tuổi trưởng thành mà không cần phải can thiệp với triệu chứng nhẹ hoặc tím.
Khi có bất thường van 3 lá dạng Ebstein, vòng van bị dịch chuyển về phía mỏm của thất phải hệ thống. tuy nhiên ở khía cạnh khác, bất thường van 3 lá hơi khác so với bất thường Ebstein khi xảy ra ở tim bình thường và van không thể sửa chữa được.Một vài mức độ bất thường của van 3 lá hiện diện trong 90% trường hợp của bất tương hợp đôi. Bệnh này nếu kết hợp với vị trí của nó ở tuần hoàn hệ thống và thuộc tính dễ bị tổn thương của van 3 lá, có nghĩa bất thường van dễ gây hở van sớm làm tăng gánh nặng của thất phải hệ thống dẫn đến tăng công.
Khi có thông liên thất kèm theo, gắn kết van 3 lá có thể bắt chéo qua lỗ thông, làm sửa chữa thành 2 thất gặp khó khăn có khi không thể được.
Nút nhĩ thất nằm ở vị trí bất thường và có thể là 2 nút với bó His dài và dễ bị xơ hóa. Hậu quả, block nhĩ thất hoàn toàn có thể biểu hiện lúc sinh hoặc bất kể lúc nào; nó có tỉ lệ tiến triển khoảng 2%/năm. Nút nhĩ thất cũng dễ bị tổn thương lúc phẫu thuật sữa chữa van 3 lá.
Biểu hiện :
Thời điểm và cách biểu hiện đầu tiên phụ thuộc van 3 lá, chức năng của thất phải và độ năng của tổn thương phối hợp. Những trường hợp nặng sẽ biểu hiện ở thời kỳ sơ sinh, còn những trường hợp không có bệnh kèm, chức năng thất phải và van 3 lá tốt có thể không biểu hiện lâm sàng đến tuổi trưởng thành,đôi khi được phát hiện tình cờ ở lứa tuổi 60.
Chẩn đoán sai thường gặp ở người lớn có biểu hiện triệu chứng lần đầu thậm chí sau khi làm hình ảnh học tim mạch. Đa số thường biểu hiện triệu chứng khó thở liên quan với rối loạn chức năng thất phải hệ thống, hở van 3 lá hệ thống hoặc block nhĩ thất.(1)
Chương này đề cập đến hai dạng của bất tương hợp đôi : (1) đơn độc, không kèm tổn thương khác ;(2) bất tương hợp đôi kèm TLT và hẹp phổi.
Khám nghiệm và khảo sát
Triệu chứng lâm sàng phụ thuộc vào các tổn thương kèm. Có thể thấy tăng động thất phải và âm thổi tâm thu của hở van 3 lá. Bệnh nhân có thể tím nếu có hẹp phổi và thông liên thất kèm. Cần tìm thêm các triệu chứng của suy tim.
Sau phẫu thuật sửa chữa có làm “ống nối”, có thể ghi nhận dấu hiệu hẹp hoặc hở “ống nối”.
Điện tim:
Dấu hiệu của dày thất phải. Các nhánh trái và phải bị đảo ngược dọc theo thất, do đó đặc tính hoạt động cũng khác thường, với kích hoạt vách liên thất từ trái sang phải. Kết quả, điện tim có thể bị phân tích sai. Chẳng hạn như nhồi máu cơ tim thành dưới với sóng Q ở chuyển đạo II, III & avF. Bị block nhĩ thất với nhiều cấp độ khác nhau.
XQ ngực :
Nếu chỉ có mỏm tim bên phải, nên nghi ngờ đến bệnh bất tương hợp đôi. Cuống tim thường hẹp,do tương quan đại động mạch bất thường. Bờ tim trái thường thẳng vì ĐMC ra từ thất phải. Tim lớn là dấu hiệu muộn của suy tim.
Siêu âm tim :
Biểu hiện của “bất tương hợp đôi” trên siêu âm hai bình diện có thể nhầm lẫn đối với bác sĩ ít có kinh nghiệm về BTBS khi khám nghiệm bắt đầu từ mặt cắt cạnh ức trục dọc. Mặt cắt dưới sườn và 4 buồng từ mỏm có ích trong xác định situs và kết nối nhĩ thất- thất đại động mạch. Hình dạng van 3 lá được xác định bởi dây chằng bám vào VLT và vị trí bám thấp hơn về phía mỏm so với van 2 lá. Nhận diện van nhĩ thất cho phép xác định thất đi theo nó : thất có dạng thất phải đi theo van 3 lá,thất có dạng thất trái đi theo van 2 lá. Hơn nữa, có thể thấy cơ bè thô và dải điều hòa của thất có dạng thất phải. Mặt cắt cạnh ức ngang cao cho thấy tương quan đại động mạch bất thường. ĐMC nằm phía trước và thường ở bên trái ĐMP. Có thể thấy hai đại động mạch song song với nhau.
Cộng hưởng từ :
Chụp cộng hưởng từ có vai trò hữu ích trong đánh giá chức năng và thể tích thất phải, mô tả giải phẩu của các tổn thương kèm.
Thông tim :
Thông tim quan trọng trong đánh giá huyết động, chức năng thất, hở van nhĩ thất và đo kháng lực mạch máu phổi.
Chăm sóc – Điều trị
Suy thất phải và hở van 3 lá :
Suy thất phải hệ thống là vấn đề chính đối với bệnh nhân bị bệnh bất tương hợp đôi và thường bắt đầu do hở van 3 là “hệ thống”. Một khi có triệu chứng thì tiên lượng xấu. Hở van 3 lá và rối loạn chức năng thất phải thường đi đôi với nhau; cả hai liên hệ mật thiết và là yếu tố chính quyết định tiên lượng lâu dài.
Có những tranh cãi đâu là bất thường tiên phát; có hai giả thuyết chính mà không thể loại trừ. Thứ nhất, van 3 lá có cấu trúc bất thường ở đa số bệnh nhân, do vậy theo thời gian, hở van 3 lá tiến triển làm tăng tải thể tích của thất phải hệ thống, gây dãn vòng van làm hở van 3 lá nặng hơn và cuối cùng dẫn đến suy thất phải. Giả thuyết thứ hai của suy thất phải hệ thống là tưới máu mạch vành không tương xứng(2). Cung cấp mạch vành cho thất phải hệ thống không giống thất trái hệ thống và có thể cung cấp máu cơ tim không đủ để đáp ứng nhu cầu của thất hệ thống. Thậm chí ở trạng thái tưới máu cơ tim bình thường lúc nghỉ, dự trữ mạch vành, đánh giá bởi tăng cầu do adenosin đều bị giảm(3).
Tuy nhiên về mặt bệnh sinh, suy tim xung huyết thường gặp người lớn có bệnh bất tương hợp đôi. Khoảng 1/3 bệnh nhân có cTGA đơn thuần và 2/3 có tổn thương kèm và phẫu thuật trước đó có vẻ dễ dẫn đến suy tim ở lứa tuổi 40(4). Hơn nữa một khi có hở van 3 lá trên mức độ trung bình, thời gian trung bình dẫn đến suy tim là 5 năm. Thêm vào đó, hở van 3 lá là yếu tố nguy cơ tử vong chính độc lập trong 1 nghiên cứu dài hạn của 40 bệnh nhân bị cTGA. Tỷ lệ sống còn của bệnh nhân hở van 3 lá vừa hoặc nặng sau 20 năm là 49% so với 93% không kèm hở van 3 lá, sống sót sau phẫu thuật sữa chữa là 60% có hở van 3 lá so với 100% không có hở van 3 lá.(5)
Nếu phát hiện có rối loạn chức năng thất phải và hở van 3 lá nặng, hở van 3 lá nên được xem là nguyên nhân nền và nên cân nhắc phẫu thuật phục hồi chức năng van 3 lá. Tuy nhiên, mặc dù có thể tiến hành thay van 3 lá với tỷ lệ tử vong phẫu thuật thấp, có ít bằng chứng cho rằng nó làm thay đổi diễn tiến, với bệnh càng trầm trọng hơn do suy tim tiến triển. Dự hậu phụ thuộc vào chức năng thất tại thời điểm phẫu thuật và bệnh nhân nên được gửi đến trung tâm có kinh nghiệm BTBS người lớn đối với việc thay van 3 lá. Trong 1 nghiên cứu lớn đa trung tâm, đa số bệnh nhân được chuyển đến trễ với hở van 3 lá nặng và phân xuất tống máu thất phải là 39%(6). Mặc dù tỷ lệ sống sót lâu dài có thể cải thiện nếu thay van 3 lá được tiến hành khi chức năng thất phải bình thường có nghĩa RVEF > 55%, không có nghiên cứu nào như vậy được báo cáo.
Thuật ngữ “ sửa chữa theo sinh lý bệnh” được sử dụng để chỉ bất kỳ tiếp cận phẫu thuật mà vẫn để thất phải trong tuần hoàn “hệ thống”. ví dụ sữa chữa cTGA có thông liên thất và hẹp phổi với ống nối thất trái- ĐMP, và đóng TLT, do vậy thất phải bơm máu lên ĐMC. Vấn đề của thất phải và van 3 lá “hệ thống” đưa đến phát triển sửa chữa phẫu thuật “giải phẫu” là đưa thất trái và van 2 lá về tuần hoàn hệ thống. Các tiếp cận phẫu thuật khác được bàn luận ở phần dưới.
Sửa chữa giải phẫu : Phẫu thuật đưa thất trái và van 2 lá về tuần hoàn “hệ thống”
Mổ “chuyển đổi đôi” (double switch) gồm chuyển cả 2 tầng nhĩ (phẫu thuật Senning) và tầng thất. Nó được tiến hành đối với cTGA kèm hoặc không kèm TLT mà không có hẹp phổi hoặc tắc nghẽn đường ra thất trái.
Đối với những bệnh nhân có tắc nghẽn đường ra thất trái, ví dụ cTGA với TLT và hẹp phổi, phẫu thuật “chuyển đổi đôi” (double switch) sẽ làm bệnh nhân hẹp van hoặc dưới van ĐMC. Thay vì vậy, phẫu thuật Senning và Rastelli nên được tiến hành ( đóng thông liên thất để thất trái nối ĐMC, cột thân ĐMP và đặt ống nối thất phải – ĐMP).
Cả hai cách tiếp cận phẫu thuật đưa thất trái và van hai lá về tuần hoàn hệ thống. Tuy nhiên, để thành công, các nhân tố cơ bản phải được đánh giá kỹ, có nghĩa thất trái đủ khả năng làm việc trong tuần hoàn “hệ thống”.
Đối với bệnh nhân không có tắc nghẽn buồng tống thất trái, thất trái sẽ thoái triển nhanh sau sinh, bởi vì nó chỉ làm việc của tuần hoàn phổi. Đến 6 tuần tuổi, thất trái ko thể làm việc dưới tuần hoàn hệ thống nếu không “huấn luyện” bằng cách siết nhỏ ĐMP. Thất trái đáp ứng bằng cách phì đại lên. Nó có thể thích hợp cho phẫu thuật “double switch” sau này và chịu được tuần hoàn “hệ thống” nếu :
- Nó có khả năng tạo áp lực 70% so với tuần hoàn hệ thống mà không bị suy trong phòng mổ ngay lập tức sau khi đặt vòng siết bớt ĐMP.
- Nó duy trì 70-80% áp lực hệ thống trong nhiều tháng trước phẫu thuật “double switch”.
- Độ dày thành sau đạt kích thước bình thường của thất trái “hệ thống”.
- Không có dấu hiệu của suy thất trái.
- Áp lực thất trái tăng “thích ứng” trong test dobutamin.
Đối với những bệnh nhân có tắc nghẽn đường ra thất trái, thất trái không thoái triển và vẫn duy trì khối cơ và chức năng bình thường. Duy trì áp lực thất trái lớn hơn 70% áp lực hệ thống là có khả năng chịu được “tuần hoàn hệ thống” sau phẫu thuật Senning – Rastelli.
Những tiếp cận “sửa chữa giải phẫu” có tỷ lệ thành công cao, với điều kiện các bệnh nhân này được chọn lựa kỹ(7). Các biến chứng lâu dài bao gồm nhu cầu thay “ống nối” sau phẫu thuật Senning – Rastelli, tắc nghẽn tầng nhĩ sau phẫu thuật Senning, hở van ĐMC-mới , và suy thất trái “hệ thống”. Các yếu tố nguy cơ suy thất trái bao gồm; hở van ĐMC, đặt máy tạo nhịp, nhu cầu siết bớt ĐMP để huấn luyện thất trái trước phẫu thuật Double Switch(8).
Suy thất trái muộn ở những bệnh nhân có siết vòng ĐMP trước đó phản ánh rằng thất trái phì đại là tiến trình bệnh lý; việc “huấn luyện”, thất trái phì đại có thể là “ một thất khác” hơn là thất trái lúc nào cũng duy trì khối cơ bình thường do tắc nghẽn buồng tống thất trái. Việc đáp ứng với “tải áp lực” của thất trái mà không được “huấn luyện” trong nhiều năm dường như không cho phép chịu đựng áp lực “hệ thống” ở dài hạn. Đa số đồng ý rằng sau 14 tuổi, các nỗ lực “huấn luyện” thất trái dường như cho kết quả Double- Switch kém thành công (9) do vậy sửa chữa theo quy ước nên được tiến hành ở người lớn.
Một báo cáo phân tích gộp trên “diễn tiến” dự hậu của phẩu thuật “giải phẫu” (đưa thất trái về tuần hoàn hệ thống) và phẫu thuật cổ điển ( để thất phải ở tuần hoàn hệ thống) cho thấy phẫu thuật Senning- Rastelli có dự hậu dài hạn tốt hơn(10).
Các vấn đề điều trị nội khoa :
Cũng giống như các dạng khác của suy tim, cách tiếp cận đa dạng là hữu ích. Các điều dưỡng chuyên khoa trong lĩnh vực BTBS, suy tim , chăm sóc hỗ trợ đều giúp cải thiện chất lượng cuộc sống, giảm nhập viện và điều trị thuốc tối ưu.
Có bằng chứng của hoạt hóa hệ thần kinh – hormon trong cTGA và các bệnh nhân khác có bệnhh TBS kèm rối loạn chức năng thất “hệ thống”, hở van nhĩ thất hệ thống, gắng sức kém, phân độ chức năng xấu(11,12). Tuy nhiên, có rất ít dữ liệu về vai trò thuốc suy tim trong cTGA hoặc trong đa số các dạng BTBS. Không có các nghiên cứu ngẫu nhiên lớn, tuy nhiên hiệu quả việc suy luận dữ liệu từ các nghiên cứu suy tim ở những bệnh nhân có kết nối bình thường giữa các “tầng tim” vào những bệnh nhân bị cTGA là không rõ. Các nghiên cứu điều trị suy tim ở cộng đồng dân số chung tập trung vào thất trái hệ thống, yếu tố nguy cơ xơ vữa động mạch và họ thường già hơn cộng đồng mắc cTGA. Thất phải hệ thống ( thất phải đáp ứng với tải áp lực khác với thất trái) cũng có vẻ đáp ứng với điều trị suy tim một cách khác biệt.
Vẫn còn những tranh luận liệu ức chế men chuyển/ ức chế thụ thể có cải thiện khả năng gắng sức hoặc chức năng thất phải hay không?(13). Hơn nữa, có nhiều nghiên cứu kết hợp bệnh nhân cTGA với những bệnh nhân đã phẫu thuật Mustard hoặc Senning hoặc chuyển vị đại động mạch đơn thuần (bất tương hợp thất – đại động nạch). Bệnh nhân đã phẫu thuật Mustard/ Senning có chức năng nhĩ giới hạn có vẻ đáp ứng khác nhau với điều trị ức chế men chuyển so với bệnh nhân cTGA. Một nghiên cứu tiền cứu nhỏ gợi ý rằng Carvedilol có thể cải thiện chức năng thất phải ở những bệnh nhân phẫu thuật Senning và cTGA.(14)
Còn ít dữ liệu về hiệu quả điều trị tái đồng bộ đối với bệnh nhân bị cTGA có suy tim. Tuy nhiên, có những quan ngại về suy thất trái dưới ĐMP sau khi đặt máy tái đồng bộ; các nghiên cứu tiền cứu cần được cân nhắc trong thực tế điều trị đối với bệnh nhân cTGA.(15)
Ghép tim là một lựa chọn khác đối với bênh nhân cTGA và suy thất hệ thống. Tuy nhiên, nếu có situs bất thường, hồi lưu tĩnh mạch bất thường, hoặc sẹo từ các cuộc phẫu thuật trước thì nguy cơ phẫu thuật ghép tim sẽ gia tăng.
Mang thai
Nguy cơ người mẹ khi mang thai phụ thuộc vào chức năng thất hệ thống và sự hiện diện bất kỳ tổn thương nào gây rối loạn huyết động. Tăng nguy cơ nếu phân xuất tống máu thất phải <40%, đặc biệt nếu có hở van 3 lá trung bình hoặc nặng, do tăng tải thể tích ngoại bào của sản phụ có thể dẫn đến suy tim, từ đó thất không hồi phục lại được. Hẹp van cũng làm tăng nguy cơ khi mang thai, do vậy sự thông thoáng của ống nối và dẫn lưu TMP sau phẫu thuật Senning cần được kiểm tra trước khi mang thai.
Ngừa thai có tầm quan trọng đối với mọi phụ nữ có bệnh tim, nếu họ mang thai không có kế hoạch có thể rất nguy hiểm đến tính mạng. Các thuốc chứa Estrogen chỉ có thể xem là an toàn nếu không làm tăng nguy cơ tạo huyết khối. Do vậy, nhiều phụ nữ có hở van 3 lá nặng và dãn nhĩ trái nên dùng thuốc chỉ chứa Progestogen.
Theo dõi
Tất cả bệnh nhân cTGA nên theo dõi suốt đời tại một trung tâm chuyên khoa BTBS người lớn. Đa số bệnh nhân nên được theo dõi tối thiểu 1 năm 1 lần, cần để ý phát hiện block nhĩ thất, hở van 3 lá, rối loạn chức năng thất. Đối với bệnh nhân đã được phẫu thuật, cần khảo sát kỹ chức năng “ống nối”, dẫn lưu tĩnh mạch và hoạt động “ĐMC-mới”. Điện tim và siêu âm tim nên tiến hành như khám nghiệm tối thiểu, khám nghiệm gắng sức và chụp cộng hưởng từ cũng cần được xem xét.
Trường hợp lâm sàng:
Đối với bệnh nhân này, thay van 3 lá được khuyến cáo trước khi bị suy thất “hệ thống”. Việc chọn lựa van sinh học hay van cơ học đã được thảo luận. Bệnh nhân chọn van cơ học vì bà ta muốn tránh phẫu thuật thêm nữa trong tương lai. Bệnh nhân chấp nhận lựa chọn này với ý thức rằng việc mang thai sẽ tăng nguy cơ do phải dùng thuốc kháng đông.
Bệnh nhân được phẫu thuật thay van 3 lá St. Jude 33mm không bị biến chứng, nhưng sau mổ bị block nhĩ thất hoàn toàn, (hình 6.3) được đặt máy tạo nhịp vĩnh viễn. Chức năng thất phải vẫn còn tốt sau mổ.
Bệnh nhân và vi hôn phu được thảo luận về nguy cơ khi mang thai tại phòng tham vấn trước sinh, có sự phối hợp của BS sản khoa va BS tim mạch. Do tăng nguy cơ khi dùng thuốc kháng đông và có khả năng chức năng thất bị xấu đi khi mang thai, họ quyết định không lập gia đình. Bệnh nhân được tránh thai bằng dụng cụ “Mirena® coil”.
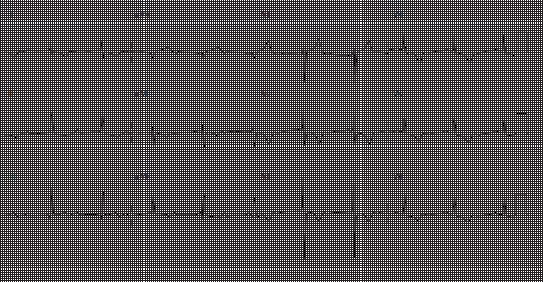
Hình 6.3:ECG sau mổ có hình ảnh block nhĩ thất hòan toàn.
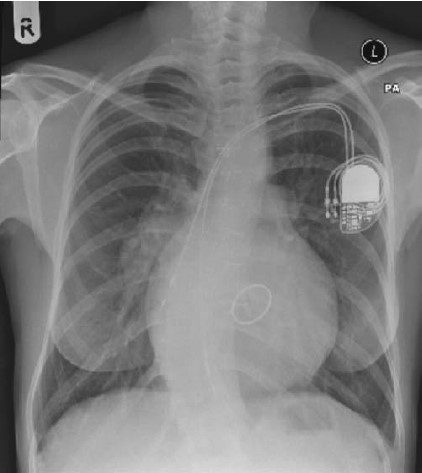
Hình 6.4: XQ sau mổ của bệnh nhân cTGA, mỏm tim chính giữa, gù vẹo cột sống. Có máy tạo nhịp 2 buồng. Điện cực thất nằm dưới ĐMP của thất có dạng thất trái. Có van 3 lá St. Jude 33mm.
Theo dõi sau 7 năm, bệnh nhân tiếp tục làm việc và du lịch nước ngoài. Bệnh nhân không bị rung nhĩ và van 3 lá “cơ học” hoạt động bình thường. Hiện tại bệnh nhân có triệu chứng NYHA II, siêu âm tim có chức năng thất phải kém hơn và sức khỏe yếu dần.
Tài liệu tham khảo
- Beauchesne L, Warnes CA, Connolly HM, et al. Outcome of the unoperated adult who presents with congenitally corrected transposition of the great arteries. J Am Coll Cardiol 2002;40:285–90.
- Hornung TS, Bernard EJ, Jaeggi ET, et al. Myocardial perfusion defects and associated systemic ventricular dysfunction in congenitally corrected transposition of the great arteries. Heart 1998;80:322–6.
- Hauser M, Bengel FM, Hager A, et al. Impaired myocardial blood flow and coronary flow reserve of the anatomical right systemic ventricle in patients with congenitally corrected transposition of the great arteries. Heart 2003;89:1231–5.86 Adeart Disease
- Graham TP, Bernard YD, Mellen BG, et al. Long-term outcome in congenitally corrected transposition of the greate arteries: a multi-institutional study. J Am Coll Cardiol 2000;36:255–61.
- Prieto LR, Hordof AJ, Secic M, et al. Progressive tricuspid valve disease in patients with congenitally corrected transposition of the great arteries. Circulation 1998;98:997– 1005.
- Van Son JA, Danielson GK, Huhta JC, et al. Late results of systemic atrioventricularvalve replacement in corrected transposition. J Thorac Cardiovasc Surg 1995;109:642–52.
- Imamura M, Drummond-Webb JJ, Murphy DJ, et al. Results of the double switch operation in the current era. Ann Thorac Surg 2000;70:100–5.
- Bautista-Hernandez V, Marx GR, Gauvreau K, et al. Determinants of left ventricular dysfunction after anatomic repair of congenitally corrected transposiotion of the great arteries. Ann Thorac Surg 2003;82:2059–66.
- Quinn DW, McGuirk SP, Metha C, et al. The morphologic left ventricle that requires training by means of pulmonary artery banding before the double-switch procedure for congenitally corrected transposition of the great arteries is at risk of late dysfunction. J Thorac Cardiovasc Surg 2008;135(5):1137–44.
- Alghamdi AA, McCrindle BW, van Ardell GS. Physiologic versus anatomic repair of congenitally corrected transposition of the great arteries: a meta-analysis of individual patient data. Ann Thorac Surg 2006;81:1529–35.
- Bolger AP, Sharma R, Li W, et al. Neurohormonal activation and the chronic heart failure syndrome in adults with congenital heart disease. Circulation 2002;106(1):92–9.
- Koch AME, Zink S, Singer H. B-type natriuretic peptide in patients with systemic right ventricle. Cardiology 2008;110:1–7.
- Dore A, Houde C, Khan KL, et al. Angiotensin receptor blockade and exercise capacity on adults with systemic right ventricles. Circulation 2005;112:2411–6.
- Giardini A, Lovato L, Donti A, et al. A pilot study on the effects of carvedilol on right ventricular remodelling and exercise tolerance in patients with systemic right ventricle. Int J Cardiol 2007;114:241–6.
- Kiesewetter C, Michael K, Morgan J, Veldtman GR. Left ventricular dysfunction after cardiac resynchronisation therapy in congenital heart disease patients with a failing systemic right ventricle. Pacing Clin Electrophysiol 2008;31:159–62.

Để lại bình luận
Bạn cần phải đăng nhập để đăng bình luận.